Диффузия. Закон Фика
В рамках кинетического подхода может быть рассмотрена также диффузия газов. Под диффузией понимают проникновение одного вещества в другое в результате теплового движения молекул. В чистом виде диффузию газов можно наблюдать только в условиях эксперимента. Две трубки, наполненные различными газами при одном давлении, ставятся одна на другую (с более тяжелым газом внизу), после чего кран, разделяющий их, открывается. Проверяя затем состав газа в трубках, можно убедиться, что газы смешиваются и смеси тем более однородные, чем больше времени прошло. Процесс этот медленный. При рассмотрении его можно считать квазистационарным. Когда смешиваемые газы близки (по массе молекул, по сечению столкновения), можно с некоторым приближением говорить о самодиффузии. Элементарная кинетическая теория дает для диффузионного потока примеси выражение
где n – концентрация молекул примеси, Закон Фика справедлив и для диффузии существенно различных газов. Но приведенное выражение для коэффициента диффузии в этом случае не применимо. Им можно пользоваться, если только концентрация примеси настолько мала, что длина свободного пробега молекул примеси определяется их столкновениями с молекулами основного газа; взаимные же столкновения молекул примеси роли не играют. Подобная ситуация имеет место в атомных реакторах при диффузии нейтронов в графите (известная проблема замедления нейронов). Когда концентрации обоих газов в смеси одного порядка, речь должна идти о взаимной диффузии. Теория в этом случае сложна. В некоторых приближенных методах расчета используется связь коэффициента диффузии с подвижностью частиц.
|

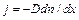 , (104.1)
, (104.1)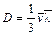 – коэффициент диффузии. Формула показывает, что диффузионный поток пропорционален градиенту концентрации. Это закон Фика. Можно образовать безразмерный параметр
– коэффициент диффузии. Формула показывает, что диффузионный поток пропорционален градиенту концентрации. Это закон Фика. Можно образовать безразмерный параметр 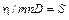 , называемый числом Шмидта. В данном случае он равен единице. Для реальных газов число Шмидта порядка единицы. Этот параметр играет роль при изучении течения газовых смесей.
, называемый числом Шмидта. В данном случае он равен единице. Для реальных газов число Шмидта порядка единицы. Этот параметр играет роль при изучении течения газовых смесей.


