Равновесие при абсорбции
При абсорбции содержание газа в растворе зависит от свойств газа и жидкости, давления, температуры и состава газовой смеси. В случае растворения в жидкости бинарной газовой смеси взаимодействуют две фазы (Ф = 2), число компонентов равно трем (
число степеней свободы системы равно трем (С=3). То есть для данной системы газ-жидкость переменными являются температура, давление и концентрации в обеих фазах. Следовательно, в состоянии равновесия при постоянном давлении и температуре зависимость между концентрациями газа и жидкости однозначна. Эта зависимость выражается законом Генри: при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
где Е – коэффициент пропорциональности, называемый константой Генри. Коэффициент Е зависит от природы растворяющегося вещества и температуры:
где Из равенств (2.1) и (2.2) следует, что с ростом температуры растворимость газов в жидкостях уменьшается. Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть заменено равновесной концентрацией. Согласно закону Дальтона, парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси:
Сопоставляя последнее равенство с (2.1), получим
В общем случае константа фазового равновесия Уравнение (2.3) выражает зависимость между равновесными концентрациями распределяемого газа в газовой и жидкой фазах. Анализ и расчет процесса абсорбции удобнее всего проводить, выражая концентрации распределяемого компонента в относительных единицах, т. к. в этом случае расчетные значения потоков газовой и жидкой фаз постоянны. Уравнение равновесия, выраженное через относительные мольные доли
можно переписать следующим образом:
При незначительных концентрациях
К факторам, улучшающим растворимость газов в жидкостях, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, – пониженное давление, повышенная температура и прибавление к абсорбенту добавок, уменьшающих растворимость газов в жидкостях. Закон Генри справедлив для смесей газов, критические температуры которых выше температуры раствора, и справедлив только для идеальных растворов, т. е. соблюдается при малых концентрациях растворенного газа или при его малой растворимости. Для хорошо растворимых газов, при больших концентрациях их в растворе, растворимость меньше, чем следует из закона Генри. Для систем, не подчиняющихся закону, коэффициент При повышенных давлениях (десятки атмосфер и выше) равновесие не следует закону Генри, т. к. изменение объема жидкости вследствие растворения в ней газа становится соизмеримым с изменением объема газа. При этих условиях константа фазового равновесия определяется следующим образом:
где Для бинарных растворов фугитивность
где А – постоянная, значение которой можно найти в справочной литературе. В случае абсорбции многокомпонентных смесей равновесные зависимости значительно сложнее, чем при абсорбции одного компонента, особенно в тех случаях, когда раствор значительно отличается от идеального. При этом парциальное давление каждого компонента в газовой смеси зависит не только от его концентрации в растворе, но также и от концентрации в растворе остальных компонентов, т. е. является функцией большого числа переменных.
|

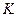 =3) и, согласно правилу фаз Гиббса
=3) и, согласно правилу фаз Гиббса
 ,
,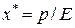 или
или 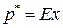 , (2.1)
, (2.1)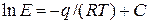 , (2.2)
, (2.2) – дифференциальная теплота растворения газа;
– дифференциальная теплота растворения газа; 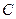 – постоянная, зависящая от природы газа и растворителя, определяемая опытным путем.
– постоянная, зависящая от природы газа и растворителя, определяемая опытным путем.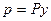 или
или 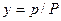 .
.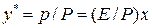 или
или 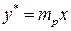 . (2.3)
. (2.3)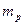 зависит от общего давления
зависит от общего давления  , температуры и концентрации распределяемого компонента в жидкости
, температуры и концентрации распределяемого компонента в жидкости 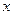 :
: 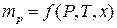 . Эта функция для некоторых систем может быть вычислена, но в большинстве случаев ее находят опытным путем.
. Эта функция для некоторых систем может быть вычислена, но в большинстве случаев ее находят опытным путем.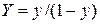 ;
; 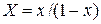 ;
; 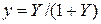 ;
;  ,
, .
.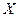 величина
величина 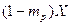 <<1, и уравнение приобретает более простой вид:
<<1, и уравнение приобретает более простой вид: .
. в уравнении равновесия является величиной переменной, и линия равновесия представляет собой кривую, которую строят обычно по опытным данным.
в уравнении равновесия является величиной переменной, и линия равновесия представляет собой кривую, которую строят обычно по опытным данным.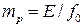 ,
,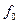 – фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления.
– фугитивность (летучесть) поглощаемого газа, выраженная в единицах давления. ,
,


