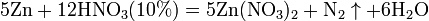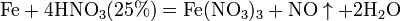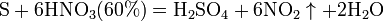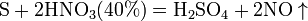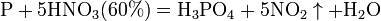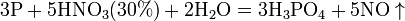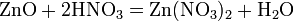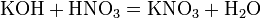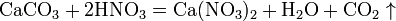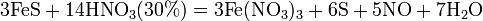Химические свойства азотной кислоты
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
При нагревании азотная кислота распадается по той же реакции. · Взаимодействие с металлами Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
а) с металлами, стоящими в ряду напряжений правее водорода: Концентрированная HNO3
Разбавленная HNO3
б) с металлами, стоящими в ряду напряжений левее водорода:
Ø С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Ø Некоторые металлы реагирующие с разбавленной азотной кислотой (железо, алюминий, хром, кобальт, никель, марганец, бериллий) холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O (с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты)
Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
а) с основными и амфотерными оксидами:
б) с основаниями:
в) вытесняет слабые кислоты из их солей:
г)
|

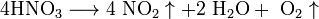
 увеличение активности металла
увеличение активности металла