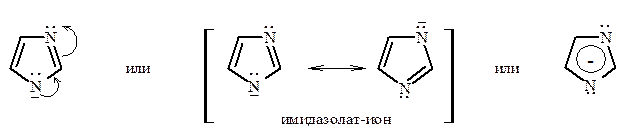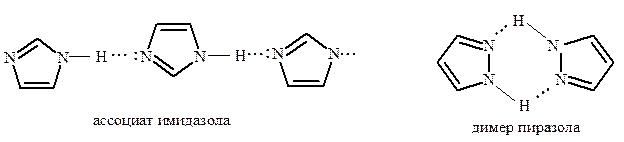Строение и общая характеристика реакционной способности. Ароматичность. Азолы относятся к 6π-электронным ароматическим соединениям
Ароматичность. Азолы относятся к 6π-электронным ароматическим соединениям. Так, в пиразоле и имидазоле один из атомов азота (N-1) принадлежит к пиррольному типу, а другой – к пиридиновому. Пиррольный атом азота вносит в сопряженную систему два р -электрона, а пиридиновый – один р -электрон. В оксазоле и тиазоле атомы азота принадлежат к пиридиновому типу, а атомы кислорода и серы имеют конфигурацию, подобную пиррольному атому азота. Все четыре гетероцикла изоэлектроны и в сопряжении принимают участие по шесть электронов, т.е. соответствует правилу Хюккеля.
Кислотные свойства присущи только диазолам – имидазолу и пиразолу, благодаря их NH-кислотному центру. Оба гетероцикла заметно превышают по кислотности пиррол (р Ка их равны 14,2). Причина этого заключается в лучшей делокализации отрицательного заряда в сопряженном основании с участием обоих атомов азота, как показано на примере имидазолат-иона:
Имидазол и пиразол проявляют амфотерный характер. В кристаллическом состоянии и в неполярных растворителях они образуют межмолекулярные ассоциаты. Ассоциаты имидазола содержат до 20 молекул, а пиразол существует в виде димеров и тримеров:
|