Общая характеристика
Все инертные газы бесцветные, лишены запаха и состоят из одноатомных молекул. Инертность этих газов обусловлена насыщенностью внешней электронной оболочки: электронные конфигурации предельно замкнуты и максимально прочны. Инертные газы диамагнитны, что вытекает из замкнутого состояния их электронной оболочки. Свойства инертных газов монотонно изменяются с переходом от легкого гелия к тяжелому ксенону. Возрастают радиус молекулы, число электронов вокруг ядра, а с ростом числа слоев электронной оболочки (табл. 1.1) ослабевает связь внешних электронов с ядром.
Таблица (1.1) Распределение электронов в атомах инертных газов Это усиливает способность молекулы деформироваться, повышает поляризацию молекулы и способствует образованию диполя. Возрастание деформируемости при последовательном переходе Не—Nе—Аг—Кг—Хе находит свое отражение в увеличении (в подобной же последовательности) растворимости, адсорбции, сжимаемости, склонности к ожижению и т. д. Более детально, с учетом энергетических подуровней s, p, d, f, электронные структуры атомов инертных газов можно представить в следующем виде: He……………………….. Ne……………………….. Ar……………………….. Xe……………………….. Kr……………………….. Где K= В табл. 1.2 приведены основные физические свойства инертных газов.
Таблица. (1.2) Основные физические свойства инертных газов
|

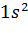


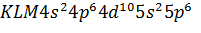

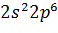 ; M=
; M=  ; N=
; N= 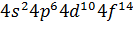 .
.


