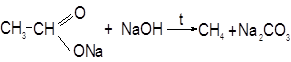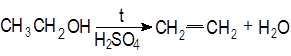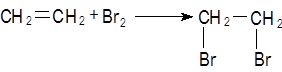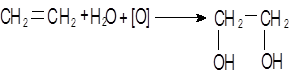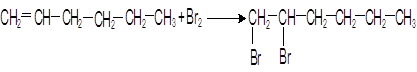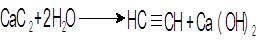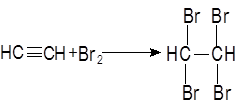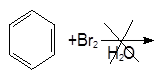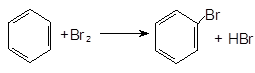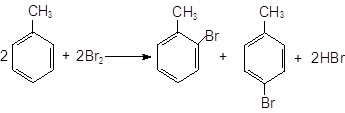МЕТОДЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА УГЛЕВОДОРОДОВ
(алканов, алкенов, алкинов, аренов)
Опыт 1. Получение и свойства метана В ступке растирают одну часть ацетата натрия (СН3СООNa) с двумя частями натронной извести (NаОН). Смесь пересыпают в сухую пробирку с газоотводной трубкой и нагревают сначала осторожно, а затем сильно.
Чтобы убедиться в том, что метан трудно вступает в химические реакции, его пропускают в пробирки, наполненные раствором перманганата калия и бромной водой. Окраска растворов при этом не изменяется, так как в обычных условиях метан не окисляется и не вступает в реакции замещения.
Опыт 2. Получение и свойства этилена. В пробирку с газоотводной трубкой помещают 1 мл этилового спирта и, осторожно взбалтывая, приливают 4 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипелку и начинают медленно и осторожно нагревать пробирку до начала равномерного выделения газа. Реакционная смесь при этом темнеет:
Заранее готовят две пробирки, заполненные на 2/3 объема бромной водой и раствором перманганата калия (розовый раствор). Как только из газоотводной трубки начинает выделяться этилен, опускают поочередно газоотводную трубку в эти пробирки. Непредельный характер этилена проявляется в быстроте его бромирования и окисления. Бромная вода обесцвечивается, так как бром присоединяется к этилену:
При окислении этилена раствором перманганата калия образуется этиленгликоль, в результате чего также происходит обесцвечивание раствора:
Эти две реакции (обесцвечивание бромной воды и раствора перманганата калия) используют как качественные реакции, позволяющие обнаружить непредельные углеводороды в нефтепродуктах.
Опыт 3. Сравнение свойств жидких алканов и алкенов. В качестве примера жидких метановых углеводородов возьмем н-гексан (CH3CH2CH2CH2CH2CH3).В качестве примера жидких алкенов возьмем гексен-1 (CH2=CH-CH2-СH2-CH2-CH3) В две пробирки наливают по 1 мл н-гексана и н- гексена. В обе пробирки прибавляют 0,5 мл бромной воды. В первой пробирке обесцвечивания не происходит, т.е. в обычных условиях н-гексан с бромом не реагирует. Во второй пробирке наблюдается исчезновение окраски, т.е. гексен-1 прореагировал с бромом:
Затем, готовят опять две пробирки с н-гексаном и гексеном и приливают по 1 мл раствора перманганата калия (KMnO4). После встряхивания содержимого пробирок отмечают, что в первой пробирке изменений не происходит, раствор не обесцвечивается, т.е. реакция не идет. Во второй пробирке характерный фиолетовый цвет исчезает, т.к. гексен реагирует с KMnO4.
Опыт 4. Получение и свойства ацетилена. В сухую пробирку помещают кусочки карбида кальция, затем прикапывают несколько капель воды и быстро закрывают пробирку пробкой с газоотводной трубкой. В пробирке наблюдается вспенивание за счет выделения газа. Опустите газоотводную трубку в пробирки с заранее приготовленными растворами бромной воды и перманганата калия. Наблюдается обесцвечивание растворов:
Опыт5. Свойства аренов. а) Бромирование бензола и толуола. В одну пробирку помещают 1 мл бензола, в другую – 1 мл толуола. В каждую из пробирок добавляют по 1 мл бромной воды и встряхивают. Пробирки нагревают на водяной бане. Бромирование бензола в этих условиях не происходит, а толуол бромируется – происходит исчезновение окраски брома. Бромирование бензола возможно только в присутствии катализатора (железные опилки). Если в первую пробирку добавить железных опилок, встряхнуть и нагреть на водяной бане, то произойдет исчезновение окраски, следовательно, бензол бромируется.
толуол орто-бром - пара-бром-
|