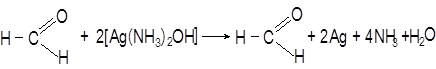КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
Опыт 1. Образование и гидролиз алкоголятов
В сухую пробирку помещают маленький кусочек металлического натрия. Добавляют 3 мл этилового спирта и наблюдают за растворением натрия в спирте с выделением водорода. К образовавшемуся этилату натрия приливают 2-3 мл дистиллированной воды, добавляют 1 каплю спиртового раствора фенолфталеина – появляется малиновое окрашивание. Алкоголяты – подобно солям очень слабых кислот при действии воды гидролизуются с образованием спирта и щелочи. Опыт 2. Окисление этилового спирта хромовой смесью Окисление спиртов в лабораторных условиях чаще всего осуществляют хромовой смесью. В сухую пробирку помещают 2 мл этилового спирта, добавляют 1 мл раствора серной кислоты и 2 мл раствора двухромовокислого калия. Оранжевый раствор нагревают на пламени горелки до начала изменения окраски на синевато-зелёную. Одновременно ощущается характерный запах уксусного альдегида. Опыт 3. Свойства фенола а) Растворимость фенола в воде В пробирку помещают 0,5 г фенола и 5 мл воды. Смесь встряхивают и дают отстояться. Наблюдается расслоение смеси, фенол полностью в воде не растворяется. Затем смесь встряхивают и нагревают на горячей водяной бане. Образующийся раствор разливают в две пробирки. б) Качественная реакция на фенол В пробирку с раствором фенола добавляют 2-3 капли раствора хлорного железа (FeCl3). Появляется фиолетовое окрашивание за счёт образования комплексной соли:
в) Получение трибромфенола В пробирку с раствором фенола добавляют по каплям раствор брома. При этом наблюдают появление белой мути за счёт нерастворимого в воде трибромфенола.
фенол 2,4,6 – трибромфенол Опыт 4. Окисление альдегидов оксидом серебра (реакция серебряного зеркала). 2AgNO3 + 2NH4OH Ag2O + 4NH3 + H2O
Предварительно готовят аммиачный раствор оксида серебра, добавляя к 4-5 мл раствора нитрата серебра разбавленный водный аммиак до растворения первоначально образующегося осадка. К раствору альдегида приливают 1 мл свежеприготовленного аммиачного раствора окиси серебра и добавляют 2-3 капли разбавленного раствора щелочи. Пробирку встряхивают и ставят в штатив. Если серебро не выделяется, пробирку нагревают. Опыт 5. Растворимость в воде различных кислот и взаимодействие со щелочами В каждую пробирку поместите несколько капель или кристаллов: 1) уксусной кислоты, 2) стеариновой кислоты, 3) бензойной кислоты, 4) щавелевой кислоты. Добавьте по 3-4 мл воды, слегка нагрейте пробирки. Горячие растворы охладите и отметьте выделение кристаллов кислот, растворившихся при нагревании. Прибавьте немного раствора щелочи. Наблюдается растворение выпавших в осадок кислот. Соли карбоновых кислот и щелочных металлов, как правило, растворимые в воде.
Список литературы: 1. Грандберг И.И. Органическая химия – М: Дрофа, 2002. – 672с., 2004, 2009г. 2. Химия нефти и газа с основами органической химии. В.Н. Кошелева. М.: РГУ Нефти и газа. 2005.180с. 3. Общая химическая технология / под ред. И.П. Мухленова (в 2-х т.).- М.:Высш.шк. 2009. 4. Фоменко А.И., Осипова В.П. Органическая химия. Методические указания по выполнению лабораторных работ – Астрахань: АГТУ, часть 1 (2001 г.), часть 2 (2002 г.), часть 3 (2002 г.).
|



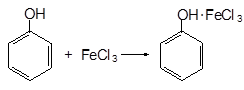
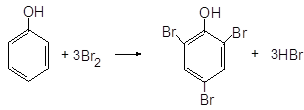
 Ag2O + 2NH4NO3 + H2O
Ag2O + 2NH4NO3 + H2O