Если же , то система находится в состоянии химического равновесия.
В соответствии с уравнением При других сочетаниях Рассмотрим две следующие реакции: 1)
2)
Первая реакция экзотермическая, протекает с уменьшением объема. Возможность этой реакции ( Вторая реакция эндотермическая. Протекает с увеличением объема. Возможность этой реакции ( Согласно уравнению Для реакции с При высоких температурах самопроизвольно можут протекать реакции, сопровождающиеся увеличением энтропии, при низких температурах – только экзотермические реакции. Процессы, протекающие с уменьшением энтальпии ( 2КClO3 = 2KCl+3O2
Под стандартной энергией Гиббса образования Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. Изменение энергии Гиббса, как и изменение энтальпии системы, не зависит от пути процесса. Поэтому для реакции вида
изменение стандартной энергии Гиббса
Для реакции NO + 1/2О2 = NO2
При пользовании значениями Во многих случаях значениями
Чем отрицательнее значение
В складских помещениях сосредоточены большие количества разнообразных по ассортименту и физико–химическим (в том числе и пожароопасным) свойствам веществ. При нарушении правил хранения возможно образование смесей, способных к экзотермическим реакциям. Такие смеси представляют значительную пожарную опасность. Одни смеси, образованные при контакте негорючего окислителя с горючим, самовозгораются (KMnO4+глицерин; CrO3+ацетон). Другие смеси воспламеняются или взрываются от удара, трения или нагревания (KClO3+сера). Третьи смеси, образованные из негорючих компонентов, при взаимодействии нагревается от теплоты реакции (CaO+вода) или взрываются (KClO3+H2SO4). Пожарную опасность веществ и их смесей можно определить по энергии Гиббса Ориентировочно за величину, определяющую направленность процесса, принимают значение 41,8 кДж/моль. Если для реакции расчетом получено Если Если для веществ по расчету получено Возможность использования энергии Гиббса для оценки пожарной опасности вещества подтверждается следующими примерами. Пример 1. Определить пожарную опасность разложения твердого окислителя KMnO4 при нагревании. Разложение вещества идет по схеме: 2KMnO4 Þ K2MnO4 + MnO2 + O2. Решение. Из справочника термодинамических величин находим
K2MnO4 – 1169,2 MnO2 – 467 Находим
Практически разложение марганцовки при стандартных условиях не происходит. Несмотря на это, KMnO4 следует считать пожароопасным веществом, так как при 240 °С процесс становится самопроизвольным и активным, с выделением О2, что представляет пожарную опасность. Пример 2. Установить пожарную опасность контакта негорючего CrO3 с горючей жидкостью ацетоном. 3C3H6O + 16CrO3 Þ 8Cr2O3 + 9CO2 + 9H2O Решение: Находим из справочника CrO3 ï – 513,8 кДж/моль Cr2O3 ï – 1059,7 кДж/моль Ацетон ï – 155,5 кДж/моль CO2 ï – 394,6 кДж/моль H2O(г) ï – 237,4 кДж/моль
Из расчета на один моль ацетона: -1826,1 кДж/моль < - 41,8 кДж/моль – возможен самопроизвольный процесс в стандартных условиях. Эксперимент показывает, что контакт этих веществ приводит к самовозгоранию и взрыву. Следовательно, совместное хранение этих веществ с точки зрения пожарной безопасности недопустимо. Литература: 1. Глинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 183-201. 2. Карапетьянц М.Х. Введение в теорию химических процессов. – М.: Высшая школа, 1981. – С. 7-75 3. Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 89-102. 4. Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С. 5. Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самосто- ятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 30-39.
Тема 5. Химическая кинетика и равновесие в гомогенных системах
Рассматриваемые вопросы: 1. Факторы, влияющие на скорость химической реакции. 2. Энергия активации химических реакций. 3. Цепные реакции. 4. Обратимые химические реакции. Химическое равновесие. 5. Факторы, влияющие на химическое равновесие. 6. Управление химическими процессами как фактор, обеспечивающий пожаровзрывобезопасность химических производств.
Химической кинетикой называется учение о скорости химических реакций и ее зависимости от различных факторов (концентрации реагентов, t, Р, катализатора и т.д.). Химические реакции протекают с различной скоростью. Одни реакции заканчиваются в течение долей секунды (разложение взрывчатых веществ), другие – продолжаются минутами, часами, сутками, третьи – длятся десятки, сотни, тысячи лет (процессы, протекающие в земной коре). Скорость конкретной реакции тоже может изменяться в широких пределах в зависимости от условий ее протекания (смесь водорода и кислорода при обычной температуре может сохраняться без изменений неограниченное время; при введении в нее соответствующего катализатора она реагирует весьма бурно; при 630 °С она реагирует и без катализатора). Фазой называется часть системы, отличающаяся по своим физическим и химическим свойствам от других частей системы и отделенная от них поверхностью раздела, при переходе через которую свойства системы резко меняются. Системы, состоящие из одной фазы, называются гомогенными, из нескольких фаз – гетерогенными. Соответственно реакции, в которых взаимодействующие вещества находятся в одной фазе, называются гомогенными, а реакции, в которых вещества соединяются в различных фазах – гетерогенными. Скорость гомогенной химической реакции принято выражать изменением концентрации реагирующих веществ или образовывающихся продуктов реакции в единицу времени. Концентрации исходных веществ в ходе реакции уменьшаются, а концентрации продуктов реакции возрастают во времени. Скорость гомогенной химической реакции по мере израсходования исходных веществ уменьшается. Средняя скорость реакции vср в интервале времени от t1 до t2 определяется соотношением:
Рис. 5.1. Изменение концентрации исходных веществ во времени.
Мгновенная скорость – это скорость реакции в данный момент времени t. Она определяется производной от концентрации по времени:
Рис. 5.2. Изменение концентрации реагирующих веществ во времени.
Скорость реакции всегда считается положительной. Если при расчетах берем изменение концентрации исходных веществ, то в указанном выражении ставится знак «-»; если это касается продуктов реакции, то следует принимать знак «+». Факторы, влияющие на скорость химической реакции: 1. природа реагирующих веществ; 2. концентрация реагентов; 3. температура; 4. катализаторы; 5. дисперсность (для твердых веществ); 6. кислотность среды (для реакции в растворах); 7. форма реактора (для цепных реакций); 8. интенсивность освещения видимыми или УФ-лучами (для фотохимических реакций); 9. интенсивность облучения
Природа реагирующих веществ 2NO + O2 = 2NO2 – идет при стандартных условиях. 2CO + O2 = 2CO2 – не реагирует при стандартных условиях, хотя чисто внешне уравнения данных реакций похожи, но природа веществ различна.
Концентрация реагентов Необходимой предпосылкой взаимодействия веществ является столкновение молекул. Число столкновений, а значит и скорость химической реакции, зависит от концентрации реагирующих веществ: чем больше молекул, тем больше и столкновений.
|

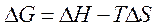 самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, то есть когда
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, то есть когда 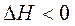 и
и 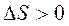 .
. и
и 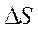 возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
возможность процесса определяют либо энтальпийный, либо энтропийный фактор.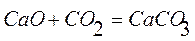
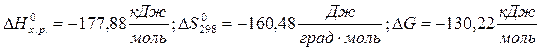 ;
;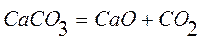
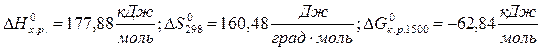 .
.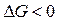 ) определяется действием энтальпийного фактора, которое перекрывает противодействие энтропийного фактора:
) определяется действием энтальпийного фактора, которое перекрывает противодействие энтропийного фактора: 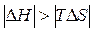 .
.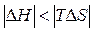 . Реакция протекает самопроизвольно.
. Реакция протекает самопроизвольно.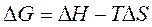 влияние температуры на
влияние температуры на 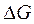 определяется знаком и величиной
определяется знаком и величиной 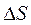 .
.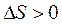 (2C + O2 Þ 2CO) повышение температуры приводит к увеличению отрицательного значения
(2C + O2 Þ 2CO) повышение температуры приводит к увеличению отрицательного значения 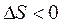 (2Hg + O2 Þ 2HgO) с повышением температуры отрицательное значение
(2Hg + O2 Þ 2HgO) с повышением температуры отрицательное значение 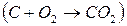 , то значение
, то значение 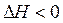 ) и увеличением энтропии (
) и увеличением энтропии (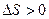 ), практически необратимы. В этом случае
), практически необратимы. В этом случае 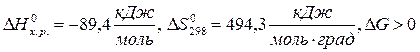 при любой температуре.
при любой температуре.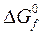 понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.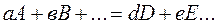
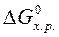 равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ: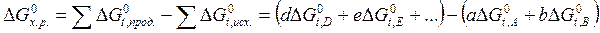 .
.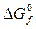 86,58 0 51,5
86,58 0 51,5 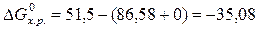 кДж/моль.
кДж/моль.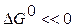 , а критерием принципиальной невозможности осуществления процесса - неравенство
, а критерием принципиальной невозможности осуществления процесса - неравенство 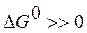 . Равенство
. Равенство 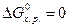 означает, что система находится в равновесии.
означает, что система находится в равновесии.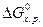 можно пользоваться лишь для приближенной оценки направления протекания реакций.
можно пользоваться лишь для приближенной оценки направления протекания реакций. C3H8
C3H8
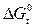 вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней
вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней 
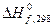 и
и 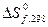 можно вычислить
можно вычислить 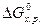 , которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
, которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).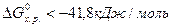 , то реакция возможна не только в стандартных, но и в нестандартных условиях.
, то реакция возможна не только в стандартных, но и в нестандартных условиях.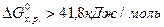 , то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
, то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).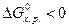 , то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При
, то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При 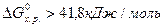 вещества совместимые и допускаются к совместному хранению.
вещества совместимые и допускаются к совместному хранению. KMnO4 – 729,6
KMnO4 – 729,6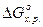 :
: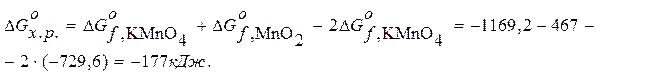 -88,5 кДж/моль < - 41,8 кДж/моль – процесс разложения KMnO4 идет самопроизвольно.
-88,5 кДж/моль < - 41,8 кДж/моль – процесс разложения KMnO4 идет самопроизвольно.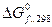 , кДж/моль:
, кДж/моль: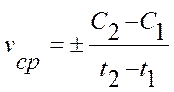 ;
;  .
.
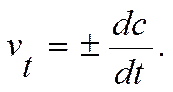

 -лучами (для радиационно – химических реакций) и т.д.
-лучами (для радиационно – химических реакций) и т.д.


