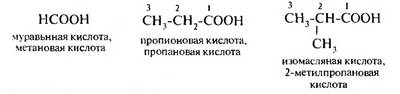Лекция 16.
КАРБОНОВЫЕ КИСЛОТЫ
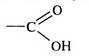
Карбоновыми кислотами называют производные углеводородов, которые содержат в своем составе карбоксильную группу. По природе углеводородного радикала различают алифатические, алициклические, ароматические, гетероциклические карбоновые кислоты и др. По количеству карбоксильных групп они делятся на моно-, ди-, три- и поликарбоновые. Алифатические карбоновые кислоты по мере насыщенности углеводородного радикала разделяют на насыщенные и ненасыщенные. МОНОКАРБОНОВЫЕ КИСЛОТЫ Монокарбоновыми кислотами называют производные углеводородов, содержащие в своем составе одну карбоксильную группу
НАСЫЩЕННЫЕ МОНОКАРБОНОВЫЕ КИСЛОТЫ Номенклатура и изомерия Для кислот более употребимы тривиальные названия, которые связаны с нахождением их в природе или источником получения. Например, муравьиная кислота (впервые выделена из муравьев), а уксусная кислота получается в результате уксусно-кислого брожения сахаристых веществ. Положение заместителей относительно карбоксильной группы в тривиальных названиях обозначают греческими буквами α, β, γи т. д.:
По заместительной номенклатуре ИЮПАК названия кислот образуют из названий углеводородов с таким же числом атомов углерода, включая и атом углерода карбоксильной группы, прибавлением суффикса -овая и слова кислота.
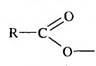
Остаток карбоновой кислоты, образующийся при отщеплении протона карбоксильной группы, называется ацилоксигруппой
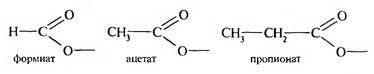
Название ее образуют от тривиального названия кислоты и суффикса -ат:
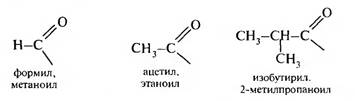
При отнятии атома водорода от карбоксильной группы образовывается ацильная группа
Ее название образуют от тривиального названия кислоты и суффикса -ил. По заместительной номенклатуре названия ацильных групп образуют от названия кислоты и заменяя -овая кислота на суффикс -оил:
Изомерия насыщенных монокарбоновых кислот обусловлена строением углеводородного радикала (структурная изомерия), начинается с 4 представителя гомологического ряда:
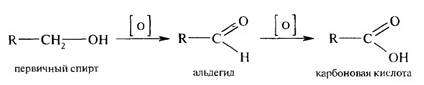
Число изомеров увеличивается по мере возрастания длины углеводородного радикала. Способы получения 1. Окисление первичных спиртов и альдегидов.
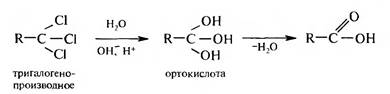
В качестве окислителей используют К2Сг207, КМп04 в кислой среде и др. 2. Гидролиз геминальных тригалогенспроимпдных углеводородов. Ре- акция протекает в кислой или щелочной среде с образованием промежуточной ортокислоты, которая в свободном состоянии не существует. Она легко теряет молекулу воды, превращаясь в карбоновую кислоту.
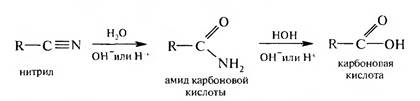
3. Гидролиз нитрилов. Нитрилы при нагревании с водным раствором кислоты или щелочи гидролизуются до карбоновых кислот:
Реакция протекает через стадию образования амидов. 4. Взаимодействие магнийорганических соединений с оксидом углерода (IV). При взаимодействии магнийорганических соединений с оксидом углерода (IV) получают соли карбоновых кислот, при подкислении которых выделяют соответствующие кислоты:
5. Гидрокарбоксилирование алкенов. Карбоновые кислоты образуются также при нагревании алкенов с оксидом углерода (II) в присутствии кислотного катализатора и повышенном давлении:
Полученные кислоты содержат на один углеродный атом больше, чем исходный алкен. Физические свойства Кислоты с числом атомов углерода не более трех представляют собой жидкости с острым запахом. Кислоты с С4—С9 — маслянистые жидкости с неприятным запахом. С числом атомов углерода 10 и выше — твердые вещества. Низшие карбоновые кислоты смешиваются с водой в любых соотношениях. С увеличением углеводородного радикала растворимость в воде уменьшается. Температура кипения кислот выше температуры кипения спиртов с тем же числом атомов углерода, что свидетельствует о большей степени их ассоциации. В результате образования межмолекулярных водородных связей карбоновые кислоты образуют как линейные, так и циклические ассоциаты, существующие в виде димеров.
Химические свойства Реакционная способность карбоновых кислот характеризуется наличием карбоксильной группы, внутри которой осуществляется сопряжение между неподеленной парой электронов атома кислорода с π-электронами карбонильной группы (р, π-сопряжение).
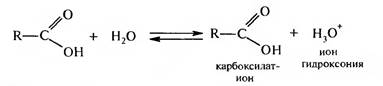
Вследствие этого связь 0←Н становится полярной и водород способен отщепляться в виде протона, что обуславливает кислотный характер карбоновых кислот. Смешение электронной плотности к атому кислорода =С=0 группы приводит к возникновению δ+ на атоме углерода карбоксильной группы, чем больше величина δ+, тем более реакционноспособны карбоновые кислоты. Основные реакции карбоновых кислот условно можно разделить на группы: • с участием связи ОН (кислотные свойства); • нуклеофильное замещение с участием атома углерода карбок сильной группы; • замещение атома водорода при а-углеродном атоме; • окисление и восстановление. Кислотные свойства В водных растворах карбоновые кислоты диссоциируют с образованием карбоксилат-иона:
Строение карбоксилат-иона можно представить с помощью двух граничных структур:
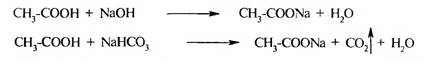
В карбоксилат-ионе оба атома кислорода равноценны, отрицательный заряд равномерно распределен между ними. Сила карбоновых кислот зависит от стабильности образовавшегося карбоксилат-иона и степени делокализации отрицательного заряда в нем. На силу карбоновых кислот также оказывает влияние структура углеводородного радикала и природа заместителей в нем. Электроно- донорные заместители дестабилизируют карбоксилат-ион и ослабляют кислотные свойства. Электроноакцепторные заместители за счет -I-эффекта способствуют делокализации отрицательного заряда в карбоксилат-ионе, повышая его устойчивость, что приводит к повышению кислотных свойств. Образование солей. При взаимодействии с активными металлами, основными оксидами, гидроксидами и карбонатами щелочных металлов карбоновые кислоты образуют соли:
Взаимодействие с гидрокарбонатом натрия является простейшей качественной реакцией на карбоксильную группу. Названия солей образуются от названий анионов карбоновых кислот:
Соли пропионовой кислоты - пропионаты, масляной — бутираты и т. д. Реакции нуклеофильного замещения. Благодаря наличию дробного положительного заряда на атоме углерода карбоксильной группы карбоновые кислоты способны вступать в реакции нуклеофильного замещения (SN). Взаимодействие со спиртами (реакция этерификации). Карбоновые кислоты реагируют со спиртами при нагревании в кислой среде. Реакция протекает с образованием сложных эфиров.
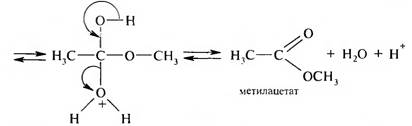
Реакция этерификации обратима, и чтобы сместить равновесие в сторону образования сложного эфира, необходим избыток спирта или кислоты или же удаление воды. Механизм реакции этерификации:
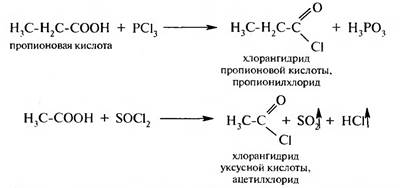
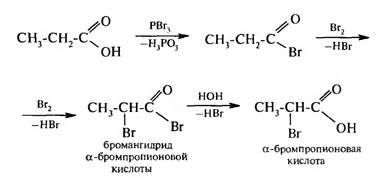
Карбоновая кислота на первой стадии протонируется по атому кислорода карбонильной группы с образованием карбкатиона, электрофильные свойства которого значительно выше, чем у исходной кислоты. Карбкатион присоединяет молекулу спирта за счет неподеленной пары электронов атома кислорода гидроксильной группы с образованием оксониевого иона, который стабилизируется путем отщепления молекулы воды и протона. В результате образуется сложный эфир. Взаимодействие с галогенирующими реагентами. При действии на карбоновые кислоты хлоридов фосфора (III) и (V), бромида фосфора (III) или тионилхлорида образуются галогенангидриды карбоновых кислот:
Галогенангидрилы кислот используются как ацилирующие реагенты. Взаимодействие с аммиаком и аминами. При взаимодействии карбоновых кислот с аммиаком, первичными или вторичными аминами образуются аммониевые соли, которые при пирролизе превращаются в амиды:
Образование ангидридов кислот. При действии водоотнимающих средств, таких, как пентаоксид фосфора (Р205) или трифторуксусный ангидрид (CF3C0)20, образуются ангидриды карбоновых кислот:
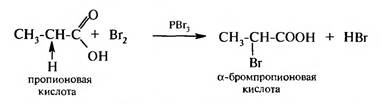
Ангидриды карбоновых кислот являются активными ацилирующими средствами. Замещение водорода при α-углеродном атоме (реакция Геля — Фоль- гарда — Зелинского). Под влиянием карбоксильной группы, которая проявляет отрицательный индуктивный эффект (—I), увеличивается подвижность атомов водорода при α-углеродном атоме. При взаимодействии карбоновых кислот с галогенами в присутствии тригалогенидов фосфора атом водорода при α-углеродном атоме замешается на галоген.
В результате реакции образуются галогенкарбоновые кислоты. Реакция протекает через стадию образования галогенангидридов, которые галогенируются легче, чем кислоты:
Окисление Монокарбоновые кислоты устойчивы к действию окислителей, кроме муравьиной кислоты, которая легко окисляется КМп04 и другими окислителями с образованием угольной кислоты:
В связи с особенностью строения муравьиная кислота обладает восстанавливающей способностью, она подобно альдегидам дает реакцию «серебряного зеркала»:
Отличительной реакцией муравьиной кислоты является также реакция ее разложения при нагревании с конц. H2S04.
В результате выделяется оксид углерода (II) и вода.
|