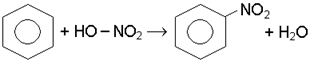
Дослiд 7.2. Синтез нiтробензолу
В суху пробiрку наливають 2 краплi концентрованої азотної кислоти i 3 краплi концентрованої сiрчаної кислоти. Отриману нiтруючу сумiш охолоджують i додають 2 краплi бензолу. Пробiрку помiщають у водяну баню, пiдiгрiту до 50-55°С на 2-3 хв, постiйно струшуючи її вмiст. Пiсля цього виливають реакцiйну сумiш в ранiше приготовлену пробiрку з водою. На дно опускається крапля важкого жовтуватого нiтробензолу, каламутного вiд присутностi вологи. Хiмiзм процесу:
Активною формою нiтруючого агента є катiон нiтронiю, який утворюється при дiї сiрчаної кислоти на азотну: НNO3 + 2H2SO4 C6H6 + бензол p–комплекс s-комплекс нітробензол
Швидкiсть реакцiї нiтрування залежить вiд об’єкта нiтрування та складу нiтру-ючої сумiшi. Для кожної сполуки iснує оптимальний склад. Дослiд 7.3. Дiя бромної води на бензол
У пробiрку вiдбирають пiпеткою 3 краплi бромної води i 2 краплi бензолу. Вмiст пробiрки енергiйно збовтують i дають вiдстоятися; верхнiй шар (бензол) забарвлю-ється у коричнево-жовтий колiр. Бром краще розчиняється у бензолi, нiж у водi, i тому переходить у верхнiй бензольний шар. Приєднання брому в цих умовах не вiд-бувається.
|


 O2 + 2HSO4- + [H3O]+. Iон гiдроксонiю [H3O]+, або
O2 + 2HSO4- + [H3O]+. Iон гiдроксонiю [H3O]+, або  , утворюється iз протону Н+ i молекули води у водних розчинах мiнеральних кислот. Катiон нiтронiю реагує з ароматичними вуглеводнями:
, утворюється iз протону Н+ i молекули води у водних розчинах мiнеральних кислот. Катiон нiтронiю реагує з ароматичними вуглеводнями: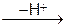 C6H5 - NO2
C6H5 - NO2


