окисно-відновних систем у водних розчинах
| Система
| φ0 , В
| AgCl + ē = Ag + Cl 
| + 0,222
| Ag  + ē = Ag + ē = Ag
| + 0,800
| As  +3ē = As +3ē = As
| + 0,300
| Br  + 2ē = 2Br + 2ē = 2Br 
| + 1,087
| BrO  + 3H + 3H  O + 6ē = Br O + 6ē = Br  + 6OH + 6OH 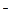
| + 0,610
| Cl  + 2ē = 2Cl + 2ē = 2Cl 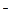
| + 1,359
| 2HClO + 2H  + 2ē = Cl + 2ē = Cl  + 2H + 2H  O O
| + 1,630
| ClO 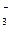 + 6H + 6H  + 6ē = Cl + 6ē = Cl 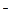 + 3H + 3H  O O
| + 1,450
| ClO 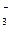 + 3H + 3H  O + 6ē = Cl O + 6ē = Cl 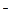 + 6OH– + 6OH–
| + 0,630
| CrO 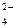 + 4H + 4H  O + 3ē = Cr O + 3ē = Cr  + 8OH + 8OH 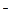
| – 0,125
| CrO 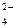 + 4H + 4H  + 3ē = CrO + 3ē = CrO 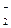 + 2H2O + 2H2O
| + 0,945
| Cr2O 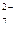 + 14H + 14H  + 6ē = 2Cr + 6ē = 2Cr  + 7H2O + 7H2O
| + 1,333
| Cu  + ē = Cu + ē = Cu 
| + 0,158
| F  + 2ē = 2F + 2ē = 2F 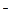
| + 2,870
| Fe  + ē = Fe + ē = Fe 
| + 0,771
| Fe(CN)  + ē = Fe(CN) + ē = Fe(CN) 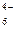
| + 0,356
| FeO 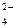 + 8H + 8H  + 3ē = Fe + 3ē = Fe  + 4H + 4H  O O
| + 1,700
| 2H  + 2ē = H + 2ē = H 
| + 0,000
| H  + 2ē = 2H + 2ē = 2H 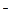
| – 2,251
| H  O O  – 2ē = O – 2ē = O  + 2H + 2H 
| – 0,682
| H  O O  + 2ē = 2OH + 2ē = 2OH 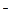
| + 0,880
| H  O O  + 2H + 2H  + 2ē = 2H + 2ē = 2H  O O
| + 1,776
| Hg  + 2ē = Hg + 2ē = Hg
| +0,854
| I  + 2ē = 2I + 2ē = 2I 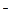
| + 0,536
| HIO + H  + 2ē = I + 2ē = I 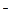 + H + H  O O
| + 0,990
| 2IO 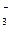 + 12H + 12H  + 10ē = I + 10ē = I  + 6H + 6H  O O
| + 1,190
| IO 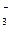 + 3H + 3H  O + 6ē = I O + 6ē = I 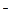 + 6OH + 6OH 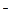
| + 0,260
| MnO  + 4H + 4H  + 2ē = Mn + 2ē = Mn  + 2H + 2H  O O
| + 1,228
| MnO 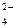 + 4H + 4H  + 2ē = MnO + 2ē = MnO  + 2H + 2H  O O
| + 2,257
| MnO 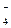 + ē = MnO + ē = MnO 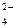
| + 0,564
| | Система
| φ0 , В
| MnO 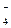 + 2H + 2H  O + 3ē = MnO O + 3ē = MnO  + 4OH + 4OH 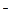
| + 0,600
| MnO 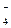 + 8H + 8H  + 5ē = Mn + 5ē = Mn  + 4H + 4H  O O
| + 1,507
| MnO 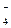 + 4H + 4H  + 3ē = MnO + 3ē = MnO  + 2H + 2H  O O
| + 1,692
| HNO  + H + H  + ē = NO + H + ē = NO + H  O O
| + 1,004
| NO 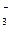 + 2H + 2H  + 2ē = NO + 2ē = NO 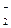 + H + H  O O
| + 0,838
| NO 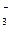 + 2H + 2H  + ē = NO + ē = NO  + H + H  O O
| + 0,772
| NO 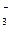 + 4H + 4H  + 3ē = NO + 2H + 3ē = NO + 2H  O O
| + 0,957
| 2NO 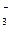 + 12H + 12H  + 10ē = N + 10ē = N  + 6H + 6H  O O
| + 1,24
| NO 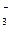 + 10H + 10H  + 8ē = NH + 8ē = NH 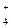 + 3H + 3H  O O
| + 0,880
| Ni(OH)  + ē = Ni(OH) + ē = Ni(OH)  + OH + OH 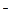
| + 0,49
| O  + 2H + 2H  + 2ē = O + 2ē = O  + H + H  O O
| + 2,075
| O  + 2H + 2H  O + 4ē = 4OH O + 4ē = 4OH 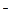
| + 0,401
| P + 3H  O + 3ē = PH O + 3ē = PH  + 3OH + 3OH 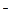
| – 0,890
| H  PO PO  + 2H + 2H  + 2ē = H + 2ē = H  PO PO  + H + H  O O
| – 0,276
| Pb 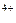 + 2ē = Pb + 2ē = Pb 
| + 1,694
| Pb  + 2ē = Pb + 2ē = Pb
| – 0,130
| PbO  + 4H + 4H  + 2ē = Pb + 2ē = Pb  + 2H + 2H  O O
| + 1,455
| PbO  + SO + SO 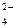 + 4H+ + 2ē = PbSO + 4H+ + 2ē = PbSO  + 2H + 2H  O O
| + 1,685
| PtCl 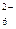 + 2ē = PtCl + 2ē = PtCl 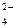 + 2Cl– + 2Cl–
| + 0,720
| S + 2ē = S 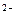
| + 0,480
| SO 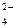 + H + H  O + 2ē = SO O + 2ē = SO 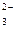 + 2OH + 2OH 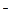
| – 0,932
| SO 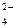 + 4H + 4H  + 2ē = H + 2ē = H  SO SO  + H + H  O O
| + 0,172
| SO 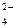 + 8H + 8H  + 6ē = S + 4H + 6ē = S + 4H  O O
| + 0,357
| SO 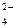 + 8H + 8H  + 8ē = S + 8ē = S 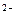 + 4H + 4H  O O
| + 0,149
| SO 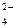 + 10H + 10H  + 8ē = H + 8ē = H  S + 4H S + 4H  O O
| + 0,31
| S  O O 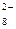 + 2ē = 2SO + 2ē = 2SO 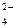
| + 2,010
| Sn 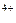 + 2ē = Sn + 2ē = Sn 
| + 1,151
| Tl  + 2ē = Tl + 2ē = Tl 
| + 1,280
| V  + ē = V + ē = V 
| – 0,255
| Sn  + 2ē = Sn + 2ē = Sn
| – 0,14
|
ЗМІСТ
| Правила роботи в хімічній лабораторії……………………………………..........
|
| |
Рекомендована література.......................................................................................
|
| | Змістовий модуль 1. Будова речовин та закономірності перебігу хімічних реакцій……………………………………………………….
|
| |
|
| |
Лабораторна робота № 1. Визначення теплового ефекту реакції.......................
|
| | Лабораторна робота № 2........................................................................................ Досліди до теми: Швидкість хімічних реакцій. Каталіз................................
Досліди до теми: Хімічна рівновага.................................................................
|
| | Змістовий модуль 2. Розчини електролітів і неелектролітів…….
|
| |
Лабораторна робота № 3........................................................................................
Досліди до теми: Електролітична дисоціація....................................................................
Досліди до тем: Йонні реакції в розчинах електролітів. Добуток розчинності малорозчинних речовин.....................................................................
Досліди до тем: Йонний добуток води. Водневий показник як кількісна характеристика кислотності-основності розчинів. Гідроліз солей.....................
Досліди до теми: Твердість води та способи її усунення..............................
|
| | Змістовий модуль 3. Електрохімічні процеси. Конструкційні матеріали
|
| |
Лабораторна робота № 4. Окисно-відновні реакції..............................................
|
| | Лабораторна робота № 5. Гальванічні елементи..................................................
|
| | Лабораторна робота № 6. Електроліз розчинів. Акумулятори...........................
|
| | Лабораторна робота № 7. Корозія металів. Методи захисту від корозії.............
|
| |
|
| | Лабораторна робота № 8.........................................................................................
Досліди до теми: Легкі конструкційні метали (алюміній, магній, титан).....
Досліди до теми: Конструкційні метали – залізо, кобальт, нікель................
Досліди до теми: Конструкційні метали – мідь, хром....................................
|
| |
Додатки.....................................................................................................................
|
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|

Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности...
|

Обзор компонентов Multisim Компоненты – это основа любой схемы, это все элементы, из которых она состоит. Multisim оперирует с двумя категориями...
|
Роль органов чувств в ориентировке слепых Процесс ориентации протекает на основе совместной, интегративной деятельности сохранных анализаторов, каждый из которых при определенных объективных условиях может выступать как ведущий...
Лечебно-охранительный режим, его элементы и значение.
Терапевтическое воздействие на пациента подразумевает не только использование всех видов лечения, но и применение лечебно-охранительного режима – соблюдение условий поведения, способствующих выздоровлению...
Тема: Кинематика поступательного и вращательного движения. 1. Твердое тело начинает вращаться вокруг оси Z с угловой скоростью, проекция которой изменяется со временем
1. Твердое тело начинает вращаться вокруг оси Z с угловой скоростью...
|
Почему важны муниципальные выборы? Туристическая фирма оставляет за собой право, в случае причин непреодолимого характера, вносить некоторые изменения в программу тура без уменьшения общего объема и качества услуг, в том числе предоставлять замену отеля на равнозначный...
Тема 2: Анатомо-топографическое строение полостей зубов верхней и нижней челюстей. Полость зуба — это сложная система разветвлений, имеющая разнообразную конфигурацию...
Виды и жанры театрализованных представлений
Проживание бронируется и оплачивается слушателями самостоятельно...
|
|