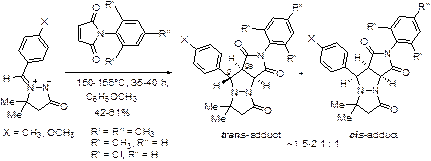ПРОСТРАНСТВЕННЫЕ ЗАТРУДНЕНИЯ ПРИ ЦИКЛОПРИСОЕДИНЕНИИ (Z)-1-АРИЛМЕТИЛЕН-5,5-ДИМЕТИЛ-3-ОКСОПИРАЗОЛИДИН-1-ИЙ-2-ИДОВ К N-АРИЛМАЛЕИМИДАМ
Антуганов Д.О. Санкт-Петербургский государственный университет, Санкт-Петербург, Россия. Студент III курса. dmantuganov@gmail.com Научный руководитель: Коптелов Ю. Б.
Стереоселективность циклоприсоединения N-арилмалеимидов к стабильным азометиниминам – (Z)-1-арилметилен-3-оксопиразолидин-1-ий-2-идам – определяется замещением как в самом азометинимине, так и в арилмалеимиде. В отсутствие заместителей в пиразолидиновом цикле, независимо от положения заместителей в малеимиде (орто - или пара -), преимущественно образуются транс -аддукты (соотношение транс -/ цис - ~ 1.4-2.6: 1), причем в случае 2,6-дизамещенных арилмалеимидов транс -аддукты являются единственными продуктами циклоприсоединения [1]. Введение в 5-е положение пиразолидинового цикла двух метильных групп приводит к преимущественному образованию цис -аддуктов (соотношение цис -/ транс - ≥ 9-10: 1) за счет пространственных затруднений, возникающих при эндо -подходе пара -замещенного арилмалеимида [2]. В случае (Z)-1-(2,6-дихлорфенил)метилен-5,5-диметил-3-оксопиразолидин-1-ий-2-ида, в котором дихлорфенильная группа выведена из плоскости азометиниминового фрагмента, в тех же условиях (110 °C, хлорбензол, 6-7 ч) конверсия не превышала 1-2%, что указывает на стерические затруднения как для экзо -, так и для эндо -подхода диполярофила. Такая же низкая конверсия наблюдалась и при взаимодействии пара -замещенных (Z)-1-арилметилен-5,5-диметил-3-оксопиразолидин-1-ий-2-идов с 2,6-дизамещенными арилмалеимидами, орто -заместители которых также создают значительные пространственные препятствия экзо -подходу диполярофила. Однако в более жестких условиях и продолжительном нагревании в анизоле (150-155 °C, 35-40 ч) нам удалось получить продукты циклоприсоединения арилмалеимидов и к этим азометиниминам. При этом стереоселективность циклоприсоединения (Z)-1-(2,6-дихлорфенил)метилен-5,5-диметил-3-оксопиразолидин-1-ий-2-иду к пара -замещенным N-арилмалеимидам составила 2.2-2.6: 1 в пользу цис -аддуктов:
Цис -конфигурация основных продуктов циклоприсоединения была установлена путем сравнения их спектров 1H ЯМР со спектрами, полученными для аддуктов (Z)-1-(4-X-фенил)метилен-5,5-диметил-3-оксопиразолидин-1-ий-2-идов с пара -замещенными N-арилмалеимидами. В случае циклоприсоединения пара -замещенных (Z)-1-арилметилен-5,5-диметил-3-оксопиразолидин-1-ий-2-идов к 2,6-дизамещенным арилмалеимидам преимущественно получались уже транс -изомеры (1.5-2.1: 1):
Транс -конфигурация основного продукта, полученного в реакции (Z)-1-(4-метоксифенил)метилен-5,5-диметил-3-оксопиразолидин-1-ий-2-ида и N-мезитилмалеимида подтверждена данными спектра 2D ЯМР 1H (NOESY), в котором наблюдались характерные кросс-пики пространственного взаимодействия между протоном в положении 9 и протонами орто -расположенной метильной группы (R' на схеме). По нашему мнению, наблюдаемая стереоселективность не может быть объяснена только стерическим влиянием заместителей в рамках согласованного механизма 1,3-диполярного циклоприсоединения, поскольку, как показывает моделирование, например, эндо -подход 2,6-дизамещенного N-арилмалеимида, ведущий к транс -аддуктам с (Z)-1-(4-метоксифенил)метилен-5,5-диметил-3-оксопиразолидин-1-ий-2-идом, должен испытывать дополнительные затруднения из-за взаимодействия орто -заместителей в малеимиде и метильными группами в 5-м положении азометинимина. Однако преимущественно образуются именно транс -аддукты. Возможно, что при повышенной температуре при наличии пространственных препятствий происходит смена механизма, и циклоприсоединение осуществляется по типу реакции Михаэля, как это было предложено для сходных по строению азометиниминов авторами [3,4].
Литература: [1] Коптелов Ю. Б., Седнев М. В. Ж. Орг. Хим. 47, 546-553 (2011). [2] Коптелов Ю. Б., Седнев М. В., Костиков Р. Р. Ж. Орг. Хим. в печати. [3] Pezdirc L., Jovanovski V., Bevk D., Jakše R., Pirc S., Meden A., Stanovnik B., Svete J. Tetrahedron 61, 3977-3990 (2005). [4] Pezdirc L., Cerkovnik J., Pirc S., Stanovnik B., Svete J. Tetrahedron 63, 991-999 (2007).
|