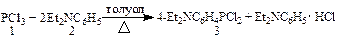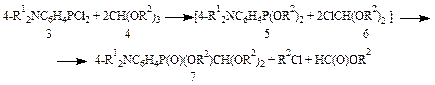ПОЛУЧЕНИЕ И СВОЙСТВА [4-(ДИЭТИЛАМИНО)ФЕНИЛ]ДИХЛОРФОСФИНА
Хайруллина О.Д.,1 Валеева Г.Д.2,Измайлова А.Р.3
1 Казанский национальный исследовательский технологический университет, Казань, Россия. Молодой учёный. Olga.hairullina@mail.ru 2 Казанский национальный исследовательский технологический университет, Казань, Россия. Аспирант 3г. 3 Казанский национальный исследовательский технологический университет, Казань, Россия. Студент VI курса. Научный руководитель: Газизов М.Б.
Ранее был описан [4-(диметиламино)фенил]дихлорфосфин (3а) [1], который был использован в синтезе гидразида [4-(диметиламино)фенил]-(2-хлорэтокси)фосфорилуксусной кислоты, проявляющего психотропную активность [2]. В литературе отсутствовали сведения об аналоге соединения (3а) с 4-(диэтиламино)фенильным радикалом у P(IV) (3б), который может быть использован в синтезе биологически активных органических соединений. Синтез [4-(диэтиламино)фенил]дихлорфосфина (3б) осуществляли взаимодействием треххлористого фосфора (1) с N,N-диэтиланилином (2) в соотношении 1.2:2.0, где второй эквивалент амина связывает хлороводород.
С целью исключения дизамещения у P(III) и образования бис[4-(диэтиламино)фенил]хлорфосфина использовали некоторый избыток PCl3, который в конце реакции удаляли вместе с растворителем. Согласно данным спектра ЯМР 31P остаток практически состоял из одного фосфорсодержащего соединения – [4-(диэтиламино)фенил]дихлорфосфина (3б). Он оказался довольно низкоплавким веществом (т. пл. 80 ºС), и очищался нами перегонкой в глубоком вакууме (т. кип. 155 ºС (0.3 мм рт. ст.). Строение дихлорфосфина (3б) подтверждали элементным анализом, спектрами ЯМР 1H и 31P и химическим методом. Приводятся характеристики его спектров ЯМР: ЯМР 1Н (CDCl3) δ, м.д.: 8.06-7.81, 7.05-6.92 м (4Н, С6H4), 3.62 к (4Н, N CH 2CH3, 3 J HH=7.0 Гц), 1.21 т (6Н, NCH2 CH 3, 3 J HH=7.0 Гц); ЯМР 31Р (ClCH2COOEt) δ, м.д.: 166.8. Нами найдено, что дихлорфосфины (3а-б) реагируют с ортомуравьиными эфирами (4) по схеме дехлороалкоксилирования. Образующиеся О,О-диалкил[4-(диалкиламино)фенил]фосфониты (5) и хлорформали (6) взаимодействуют между собой, образуя ранее неизвестные аминосодержащие фосфорилированные формали – О-алкил(диалкоксиметил)[4-(диалкиламино)фенил]фосфинаты (7).
3, R1= Me (a), Et (б); 4, R2=Me (a), Et (б); 7, R1=Me, R2=Me (a), Et (б); R1= Et, R2=Me (в), Et (г). Строение и структура соединений (7) было подтверждено элементным анализом и спектрами ЯМР 1H и 31P. Приводятся характеристики спектров ЯМР О-метил(диметоксиметил)[4-(диэтиламино)фенил]фосфината: ЯМР 1H (CDCl3) δ, м.д.: 7.76-7.45, 6.78-6.53 м (4Н, С6Н4), 4.59 д (1Н, СН, 2 J PH=2.3 Гц), 3.69 д (3Н, PO CH 3, 3 J PH=10.6 Гц), 3.47 с (6Н, CH(O CH 3)2), 3.35 к (4H, N CH 2CH3, 3 J HH=7.0 Гц), 1.14 т (6Н, NCH2 CH 3, 3 J HH=7.0 Гц); ЯМР 31Р (C6H5CH3) δ, м.д.: 32.9. Испытания на биологическую активность формалей (7) показали, что они проявляют бактерицидную и психотропную активность.
Работа выполнена при финансовой поддержке Федеральной целевой программы «Научные и научно-педагогические кадры инновационной России на 2009-2013 годы» (госконтракт № П-1108).
Литература: [1] Кормачев В.В., М.С. Федосеев. Препаративная химия фосфора. – Пермь: УрО РАН, 1992, 468 с. [2] Пат. 2141961 Российская Федерация, МПК С 07 F 9/32, А 61 К 31/66. Эфиры фосфиновых кислот или их физиологически приемлемые соли, фармацевтическая композиция на их основе и способ коррекции нарушений обменных процессов мозга / Р.И. Тарасова; заявитель и патентообладатель Казан. хим.-технол. ун-т. - № 94000647/04; заявл. 11.01.1994; опубл. 27.11.1999.
|