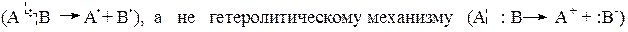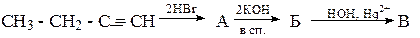Предельные и непредельные углеводороды
Алканы
Алканы или парафины – алифатические предельные углеводороды, в молекулах которых атомы углерода связаны между собой s-связью. Атомы углерода в предельных углеводородах находятся в первом валентном состоянии (sp3 – гибридизации). Это значит, что углеродные атомы в алканах полностью насыщены водородом. Поэтому предельные углеводороды не вступают в реакции присоединения. Они проявляют при обычных условиях чрезвычайно высокую химическую инертность: не взаимодействуют с кислотами, щелочами, окислителями, активными металлами (например, металлический натрий можно хранить в керосине). Основные химические превращения предельных углеводородов идут только при сообщении им достаточно высокой энергии (за счет нагревания или УФ–облучения). При этом происходит разрыв связи С–Н с последующим замещением атома водорода на другие атомы, или разрыв молекулы по связи С–С. Связи С–С и С–Н, образованные по типу ковалентной и ковалентно-полярной, при разрыве образуют радикалы, т.е. этот разрыв идет по гомолитическому
Таким образом, для предельных углеводородов различают два основных типа химических реакций: 1) реакции замещения водорода с разрывом связи С – Н; 2) реакции расщепления молекулы с разрывом С – С-связей.
Лабораторная работа Цель работы: получение и изучение химических свойств алканов. Реактивы и оборудование: 2н. HCl; 0,1н. KMnO4; 0,1н. Ba(OH)2 (баритовая вода); Br2 в CCl4, Br2 в Н2О; гексан; гептан, ацетат натрия (обезв.), натронная известь. штатив с пробирками, держатель для пробирок; газоотводная трубка; спиртовка. Опыт 1.1 Получение метана и исследование его свойств В пробирку А, снабженную пробкой с газоотводной трубкой, помещают смесь равных весовых частей обезвоженного (сплавлением) ацетата натрия и натронной извести на высоту около 10 мм. Держа пробирку в горизонтальном положении, нагревают ее в пламени спиртовки и поджигают газообразный метан, выделяющийся из отверстия трубки. Что наблюдается? Обращают внимание на цвет пламени. Убедившись, что метан горит, тотчас опускают конец газоотводной труби в пробирку с заранее приготовленным раствором марганцево-кислого калия (1 каплю 0,1н KMnO4 и 5 капель воды). Что при этом происходит? После этого опускают конец газоотводной трубки во вторую пробирку, предварительно поместив в эту пробирку 5 капель бромной воды. Какие изменения при этом наблюдаются? Чтобы убедиться какие химические процессы протекают при образовании метана, в охлажденную пробирку А добавляют 2-3 капли 2н. HCl. Что при этом происходит? Пропускают газ в предварительно приготовленный раствор с 2-3 каплями гидрата окиси бария. Что при этом наблюдается? На основании этого наблюдения написать уравнение реакции. Опыт 1.2 Свойства предельных углеводородов В две пробирки помещают по 1 мл предельного углеводорода (гексана или гептана). В первую пробирку добавляют 1 мл раствора брома в CCl4. Почему не происходит обесцвечивание раствора? Во вторую пробирку добавляют 1 мл раствора перманганата калия в воде. Встряхивают содержимое. Обесцвечивание раствора не происходит. Почему? Вопросы для контроля 1. Основные положения теории химического строения органических соединений А.М. Бутлерова. 2. Перечислите основные типы связей между атомами в органических соединениях. 3. Понятие о гибридизации электронных орбиталей атома углерода. 4. Химические свойства алканов.
Упражнения по теме «Алканы» 1. Сколько надо взять оксида углерода (IV) и водорода, чтобы получить 1,4 л метана? 2. Сколько потребуется ацетата натрия, чтобы получить 5,6 л метана? 3. Напишите структурные формулы изомерных углеводородов состава С6Н14; укажите изомеры, содержащие третичные атомы углерода. Назовите углеводороды по номенклатуре ИЮПАК. 4. Напишите схему получения 2-метилбутана любым способом и уравнения реакций его нитрования, бромирования и сульфирования. Укажите условия проведения реакций. 5. Какие углеводороды получаются при действии металлического натрия на смесь: а) 2-йодпропан и 1-йод-2-метилпропан; б) 1-бромпропан и 2-бромбутан. 6. Получите реакцией Вюрца следующие углеводороды: а) 2,6-диметилгептан; б) 3,4-диметилгексан; в) 2,5-диметилгексан. 7. Превратите 1-бром-2-метилпропан в предельный углеводород: а) с тем же строением углеродного скелета и тем же числом углеродных атомов; б) с удвоенным числом углеродных атомов. 8. Сколько структурных изомеров имеет пентан? Напишите их структурные формулы и назовите их по номенклатуре ИЮПАК. 9. Напишите реакции получения 2,5-диметилгексана: а) по реакции Вюрца; б) гидрированием соответствующих олефинов; в) декарбоксилированием соответствующей карбоновой кислоты. 10. Из неорганических веществ получите пропан. 11. Получите 2-метилбутан: а) гидрированием непредельного углеводорода; б) восстановлением галогенопроизводного углеводорода. 12. Образец вещества с массой 2,15 г при сожжении дал 6,6 г СО2 и 3,15 г Н2О. Молекулярная масса вещества 86. Найдите его молекулярную формулу и напишите формулы всех изомеров. 13. Приведите все способы получения пропана. 14. Из метана получите пропан. 15. Напишите углеводороды, которые получаются в следующих реакциях восстановления: а) 1-бром-2-метилпропан + HI; б) 2-бром-2-метилбутан + Н2; в) 3-йод-2-метилпентан + Zn + HCl
Алкены Алкенами называются углеводороды, в молекулах которых имеется одна двойная связь, состоящая из одной s- и одной p-связи. В алкенах атомы углерода находятся во втором валентном состоянии – (sp2 – гибридизации). Химические свойства алкенов определяет двойная – углерод – углеродная связь. При действии на двойную связь различных реагентов разрывается p-связь, как наименее прочная и более реакционноспособная. Это объясняется тем, что образующие ее р-электроны более доступны для электрофильного реагента, чем электроны s-связи. В химических превращениях алкены выступают в качестве доноров электронов. Поэтому электрофильные реагенты как (H2O, HCl, HOCl, H2SO4 и пр.) энергично взаимодействуют с ними. Эти реакции, протекающие по гетеролитическому механизму, называются реакциями электрофильного присоединения (АЕ). Реакции с нуклеофильными реагентами, а также реакции присоединения, протекающие по гомолитическому механизму с участием свободных радикалов (АR) для алкенов менее характерны. Алкены легко окисляются. Направление окисления и характер образующихся продуктов зависят от строения алкенов, вида окислителя и условий окисления. Некоторые алкены легко вступают в реакцию полимеризации.
Лабораторная работа Цель работы: получение и изучение химических свойств алкенов. Реактивы и оборудование: 0,1н. KMnO4, H2SO4 конц; Br2 в Н2О; Al2O3 (порошок). штатив с пробирками; держатель для пробирок, газоотводная трубка; спиртовка. Опыт 1.3 Получение этена и изучение его свойств В пробирку А помещают 8 капель концентрированной серной кислоты, 4 капли этанола и несколько крупинок оксида алюминия в качестве катализатора. Пробирку А закрывают пробкой с газоотводной трубкой и конец ее опускают в пробирку Б с 4 капялями насыщенной бромной воды. Нагревают на пламени спиртовки пробирку А. Запишите свои наблюдения. После этого конец газоотводной трубки опускают в заранее приготовленную пробирку В с 1 каплей 0,1н. KMnO4 и 5 каплями воды. Продолжая нагревание пробирки А, обратите внимание на изменение окраски раствора KMnO4. Убирают пробирку В и поджигают газообразный этен у конца газоотводной трубки. Опишите свои наблюдения и дайте уравнения протекающих реакций. Вопросы для контроля 1. Какие углеводороды называются алкенами? 2. Изомерия алкенов. 3. Понятие sp2-гибридизации электронных орбиталей атома углерода. 4. Способы получения этиленовых углеводородов. 5. Химические свойства алкенов.
Упражнения по теме «Алкены» 1. Напишите структурные формулы всех изомерных алкенов состава: а) С4Н8 б) С5Н10 2. Какими способами можно получить пропен (пропилен?) 3. Получите соответствующие алкены из: а) 1-хлорпентана б) 3-иод-2-метилбутана. 4. Какие соединения получаются при дегидратации следующих спиртов: а) бутанол-1 б) 2-метилпентанол-3 в) бутанол-2 г) 2,3-диметилбутанол-2. Сформулируйте правило Зайцева. 5. Какие соединения получаются при гидробромировании следующих веществ: а) пентен-1 б) 2-метилбутен-2 в) 3,3-диметилбутен-1 Сформулируйте правило В.В. Марковникова. 6. Напишите схемы реакций окисления по Вагнеру следующих соединений: а) пентен-3 б) 2,3-диметилбутен-2 в) пропен 7. Какова структурная формула вещества, если при разложении озонида водой получится ацетон и уксусный альдегид? 8. Напишите схемы реакций гидратации следующих алкенов: а) пентен-1 б) 2-метилбутен-2 в) пропен 9. Из 1-бромбутана получите бутен-2. 10. Получите любым способом 2-метилбутен-2. Напишите для него уравнения реакций с: а) HBr б) O3 в) H2SO4 г)KMnO4 (H2O) 11. Какие соединения получаются в результате следующих превращений:
12. Из этена получите бутен-2. 13. Из метана получите бутен-1. 14. Из этана получите этен, не прибегая к реакции дегидрирования. 15. Из одноатомного спирта получен алкен симметричного строения, 14 г которого вступает в реакцию с 40 г брома. Каково строение исходного спирта?
Алкины Алкинами называют алифатические углеводороды, содержащие в молекуле одну тройную связь, которая состоит из одной s-связи и двух p-связей. У атома углерода, связанного тройной связью, гибридизованы одна s- и одна р-орбиталь, поэтому он находится в состоянии sp-гибридизации. Две гибридные sp-орбитали каждого атома углерода, образуют одинарные s-связи с атомом водорода и соседним углеродом. Оставшиеся две р-орбитали атома углерода перекрываются с аналогичными орбиталями другого углеродного атома и образуют две p-связи. Межъядерное расстояние атомов углерода в этине (0,1203 нм) меньше, чем в этене (0,1332 нм) и этане (0,154 нм). Большая степень связывания атомов углерода тройной связью, чем двойной, приводит к ее упрочению и укорачиванию. Вследствие этого p-электроны в большей степени сконцентрированы в пространстве между ядрами, и поэтому внешние области ядра оказываются относительно обедненными электронной плотностью. Этим объясняется меньшая активность ацетиленовой связи по сравнению с этиленовой к реакциям электрофильного присоединения (АЕ) и большая склонность к взаимодействию с нуклеофильными реагентами (SN), которые замещают водород в молекуле алкина. Изменение характера гибридизации атома углерода в ряду этан-этилен-ацетилен приводит к возрастанию его электроотрицательности. Поэтому sp-гибридизация обуславливает смещение s-электронов связи Сd- Нd+ к углероду и поляризацию связи, вследствие чего уменьшается межъядерное расстояние, увеличивается дипольный момент этой связи и усиливается способность водорода отрываться в виде протона. Действительно, кислотность этина по сравнению с этеном и этаном наибольшая. Можно предвидеть несколько направлений, по которым будут реагировать ацетиленовые углеводороды: а) присоединение по месту разрыва тройной связи; б) замещение водородных атомов у углерода при тройной связи; в) присоединение алкинов с разрывом связи углерод – водород.
Лабораторная работа
Цель работы: получение и изучение химических свойств алкинов. Реактивы и оборудование: 0,1н. KMnO4, фенолфталеин, 1% -спиртовый рас твор; Br2 в Н2О; карбид кальция (СаС2). штатив с пробирками, газоотводная трубка, спиртовка. Опыт 1.4 Получение этина и изучение его свойств В пробирку А поместить маленький кусочек карбида кальция СаС2 и добавить 2 капли воды. Что происходит при этом? Горит ли образовавшийся газ? После этого, полученный газ пропустить в раствор из 5 капель воды и 1 капли 0,1н KMnO4, а затем в раствор из 5 капель бромной воды. Какие изменения при этом происходят? В пробирку А по окончании реакции добавить 1 каплю спиртового раствора фенолфталеина. Объясните появление ярко-красного окрашивания? Вопросы для контроля 1. Какие углеводороды называются алкинами? 2. Изомерия алкинов. 3. Понятие sp-гибридизации электронных орбиталей атома углерода и характер кратных связей в алкинах.. 4. Способы получения алкинов. 5. Химические свойства алкинов. Упражнения по теме «Алкины» 1. Из метана получите пропин. 2. Из этана получите этин, не прибегая к реакции дегидрирования. 3. Из этина получите 2-хлорбутадиен-1,3. 4. Напишите реакции гидратации для следующих углеводородов: а) этин б) бутин-1. 5. Напишите для пропина уравнения реакций со следующими веществами: а) СН3ОН б) HBr в) HOH
6. Какие соединения получаются в результате следующих превращений:
7. Какие соединения получаются при гидрохлорировании следующих веществ: а) бутин-1
8. Из карбида кальция получите бутин-1. 9. Напишите формулы промежуточных и конечных веществ в следующих схемах:
10. Получите любым способом бутин-1. Напишите для него уравнения реакций: а) HBr б) KMnO4 (H2O) в) НОН 11. Какие соединения получаются в результате следующих превращений:
12. На этин подействуйте следующими веществами: а) СН3СН2ОН б) СН3СООН в) HCN
13. Из карбида кальция получите: а) СН2 = СН - СN
14. Из 1-бромбутана получите бутин-2. 15. Из пропанона и йодметана получите 2-метилбутин-3-ол-2.
|