И в боковой цепи
а). Помещают в пробирку 1 каплю хлорбензола (С6H5Cl) и 5 капель воды. Содержимое пробирки нагревают до кипения и к горячему раствору прибавляют 1 каплю 0,2н AgNO3. Что при этом наблюдается? б) Помещают в пробирку 1 каплю хлористого бензила (С6H5СН2Cl) и 5 капель воды. Содержимое пробирки нагревают до кипения и к горячему раствору прибавляют 1 каплю 0,2н AgNO3. Что при этом происходит? Описать в журнале.
Вопросы для контроля 1. Изомерия и номенклатура галогенпроизводных углеводородов. 2. Полярность связи углерод – галоген, индуктивный эффект. 3. Реакция нуклеофильного замещения. Механизм реакции. 4. Сравнительная подвижность атома галогена в зависимости от типа радикала. 5. Методы получения галогенопроизводных углеводородов.
Упражнения по теме «Галогенопроизводные углеводородов» 1. Напишите структурные формулы всех галогенозамещенных с формулой С5Н11Cl. Назовите эти соединения по номенклатуре ИЮПАК. 2. Напишите уравнения реакций взаимодействия 2-бромбутана со следующими соединениями: а) магнием; б) аммиаком; в) цианистым калием; в) водным и спиртовым раствором щелочи. 3. Из пропина получите 1-хлорпропен-2. 4. Из этина получите 2-хлорбутадиен-1,3-хлоропрен. 5. Из метана получите этановую кислоту, используя реактив Гриньяра. 6. Получите хлорэтен (CH2 = CH – Cl), исходя из этена и этина. 7. Из бензола получите 2,4-динитрохлорбензол и 2,5-дихлорнитробензол. 8. Напишите схемы реакций полимеризации: а) хлористого винила; б) 2-хлор-1,3-бутадиена. 9. Из этаналя получите бромоформ (CHBr3). 10. Напишите схему следующих превращений: СН3 – СН2 – СН2 – СН3 Назовите соединения А, Б, В, Г, Д. 11. Из этана получите хлорэтен (CH2 = CH – Cl). 12. Из дибромэтана получите 1,2-дибромбензол. 13. Из этина получите 1-бром-4-хлорбензол. 14. Как осуществить следующие превращения:
СН3 – СН = СН2 СН3-СН2 – СН2 - Br СН3 – (СН2)4 – СН3 СН3 – СН2 – СН2 – СН3 СН3 – СН2 – СН3
n-хлортолуол и хлористый бензил? Спирты
Спирты или алкоголи-производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на соответствующее число гидроксильных групп. Химические свойства спиртов определяются реакционноспособной гидроксильной группой и строением связанного с ней радикала. Реакции, в которые вступают спирты, можно разбить на следующие группы: I. Реакции идущие с участием только атома водорода гидроксильной группы (разрыв связи О – Н). II. Реакции, происходящие с замещением или отщеплением всей гидроксильной группы (разрыв связи С – О) III Реакции окисления, в которых одновременно принимают участие гидроксильная группа, a-водородные атомы или соседние связи углерод – углерод. Спирты – практически нейтральные вещества. Однако, атом водорода гидроксильной группы, обладая некоторой подвижностью, способен вступать в реакции замещения. Кислород как более электроотрицательный элемент, оттягивая электронную плотность в свою сторону, способствует поляризации связи О – Н: d- d+ R – O H В результате происходит замещение атома водорода на щелочные или, при соответствующих условиях, на другие металлы (Ca, Al, Mg). По способности отщепления водорода спирты можно расположить в такой ряд: первичные ® вторичные ® третичные. При окислении спиртов образуются различные продукты. Первичные спирты при этом переходят в альдегиды, а вторичные – в кетоны:
Третичные спирты наиболее стойки к действию окислителей. Поэтому при их окислении в жестких условиях происходит расщепление молекулы с образованием смеси кислот.
|

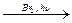 А
А 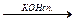 Б
Б  В
В 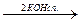 Г
Г 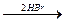

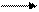
 СН3 – С º СН
СН3 – С º СН 15. С помощью каких реакций можно различить изомерные соединения:
15. С помощью каких реакций можно различить изомерные соединения: