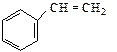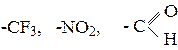Лабораторная работа. Цель работы: изучение физических и химических свойств ароматических углеводородов.
Цель работы: изучение физических и химических свойств ароматических углеводородов. Реактивы и оборудование: 0,1н. KMnO4; 2н. H2SO4; H2SO4 конц.; Br2 в Н2О; Br2 в СCl4; бензол; толуол; нитрат аммония NH4NO3 (сухое вещество). штатив с пробирками; держатель для пробирок; газоотводная трубка; спиртовка. Опыт 2.1 Растворимость бензола в воде 1. В пробирку с 5 каплями воды добавляют 5 капель бензола и перемешивают. После стояния делают вывод о растворимости бензола в воде. 2. Отношение бензола к бромной воде. В пробирку с 3 каплями бромной воды добавляют 3 капли бензола. Содержимое тщательно перемешивают. Бензол легче воды и в ней не растворяется. Поэтому после встряхивания смеси бензола он всплывает наверх при стоянии. Нижний слой бромной воды при этом обесцвечивается. Однако такое обесцвечивание объясняется не тем, что бром присоединяется по месту двойных связей, как это наблюдалось, например, у этена, а тем, что бром лучше растворяется в бензоле, чем в воде, и поэтому переходит в верхний слой бензола, окрашивая его в желтый цвет. Это процесс физический, а не химический. 3. Отношение бензола к раствору перманганата калия в кислоте. В пробирку с 5 каплями воды добавляют 1 каплю 0,1н KMnO4 и 1 каплю H2SO4. К полученному розовому раствору добавляют 1 каплю бензола и встряхивают. Что происходит с раствором? На основе своих наблюдений сделайте выводы о реакционной способности бензола. Опыт 2.2 Окисление боковых цепей гомологов бензола В пробирку с 5 каплями воды помещают 1 каплю 0,1н. KMnO4 и 1 каплю 2н. H2SO4. Добавляют 1 каплю толуола и, энергично встряхивая, нагревают над пламенем горелки. Какие изменения происходят при нагревании? Опыт 2.3 Получение динитробензола (реакция Степанова) В сухую пробирку помещают 1 лопаточку нитрата аммония (NH4NO3), растворяют его в 1 мл конц. H2SO4 под вытяжным шкафом и к охлажденному раствору добавляют 1-2 капли бензола. При хорошем перемешивании бензол растворится (иногда надо слегка подогреть). Реакционную смесь выливают в другую пробирку с холодной водой. Что при этом происходит? Вопросы для контроля 1. Понятие ароматичности. Правило Хюккеля. 2. Классификация ароматических углеводородов. Изомерия. Номенклатура. 3. Способы получения ароматических углеводородов. 4. Химические свойства ароматических углеводородов.
Упражнения по теме «Ароматические углеводороды» 1. Напишите структурные формулы двух соединений С8Н10, если при их окислении получены: из одного – бензойная кислота, из другого – пара-С6Н4(СООН)2. 2. Напишите, пользуясь правилами замещения в бензольном ядре, схемы реакций между: а) бензойной кислотой и азотной кислотой (в присутствии H2SO4); б) бензойной кислотой и хлором (в присутствии FeCl3); в) толуолом и серной кислотой; г) фенолом и азотной кислотой. 3. Напишите схемы бромирования толуола: а) в присутствии катализатора на холоду; б) в отсутствии катализатора при нагревании. 4. Получите орто-хлорнитробензол и мета-хлорнитробензол из бензола. 5. Какие продукты образуются при энергичном окислении толуола, этилбензола, изопропилбензола (кумола). 6. Предложите схему получения бензола из метана. 7. Предложите способ синтеза следующих соединений из бензола: а) мета-хлорбензолсульфокислоты; б) пара-нитробензойной кислоты; в) 2,4-дихлорбензойной кислоты; г) мета-нитробензойной кислоты. 8. Напишите структурные формулы промежуточных и конечных продуктов реакций следующей схемы превращений:
9. Из толуола получите
10. Из бензола получите бензолгексахлорид С6Н6Cl6 (инсектицид). 11. Из карбида кальция получите стирол
12. Объясните, почему группы
должны быть мета ориентантами и обладать дезактивирующим действием? 13. Напишите механизм бромирования бензола бромом в присутствии AlBr3 как катализатора. 14. Напишите структурную формулу углеводорода С9Н10 обесцвечивающего бромную воду, при окислении хромовой смесью образующего бензойную кислоту, а при окислении по Вагнеру – 3-фенил-пропандиол-1,2. 15. Рассчитайте, сколько KMnO4 (в нейтральной среде, потребуется для окисления 9,2 г толуола до бензойной кислоты.
|