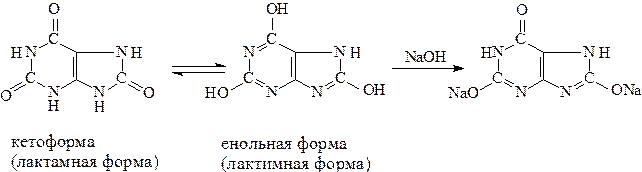натриевой соли в воде
Поместить в пробирку небольшое количество (на кончике лопаточки) мочевой кислоты. Прибавить по каплям воду, каждый раз встряхивая пробирку. Обратить внимание на плохую растворимость мочевой кислоты в воде. В холодной воде мочевая кислота почти нерастворима: 1часть ее растворяется в 39000 частях воды. После добавления 8 капель воды растворения все еще не заметно. Стоит, однако, добавить всего 1 каплю 2н. NaOH, как мутный раствор моментально просветляется, вследствие образования относительно легкорастворимой средней двузамещенной соли натрия. Полученный раствор сохранить для последующих опытов. Мочевая кислота существует в виде двух таутомерных форм:
От лактимной-енольной формы и образуются со щелочью так называемые соли мочевой кислоты, или ураты. Фактически это не соли, а еноляты. Очень слабо выраженный кислотный характер мочевой кислоты обусловливает то, что из трех атомов водорода теоретически возможной енольной формы могут замещаться на натрий только два. Трехзамещенные соли мочевой кислоты неизвестны. Опыт 12.6 Образование труднорастворимого урата аммония К четырем каплям прозрачного раствора средней двузамещенной натриевой соли мочевой кислоты (опыт 60) добавить две капли насыщенного раствора хлорида аммония. Немедленно выпадает белый осадок мочекислого аммония. Сохранить этот осадок для последующего опыта выделения свободной мочевой кислоты (опыт 62). Написать схему реакции, учитывая, что оба иона натрия замещаются в урате натрия на ионы аммония. Опыт 12.7 Разложение уратов под влиянием минеральной кислоты (выделение кристаллической мочевой кислоты) С помощью пипетки нанести на предметное стекло одну каплю мутного раствора, содержащего мочекислый аммоний (опыт 61). Добавить в центр капли одну каплю 2н. HCl. Наблюдается частичное растворение осадка. При рассматривании под микроскопом видны желтоватые глыбки еще не разложившегося урата аммония и вновь образовавшиеся характерные кристаллы мочевой кислоты в виде удлиненных призм, напоминающих точильные бруски. Зарисовать в рабочем журнале форму кристаллов полученного препарата. Отложение кристаллов мочевой кислоты в организме (мочевые камни, подагрические узлы и т.п.) происходит под влиянием изменения реакции среды в сторону увеличения кислотности. Написать схему выделения мочевой кислоты из ее соли.
Вопросы для контроля 1. Какие соединения называются гетероциклическими? 2. Классификация гетероциклических соединений? 3. В чем выражается ароматичность гетероциклических соединений? 4. Напишите формулы гетероциклов, входящих в состав аминокислот. 5. Биологическая роль пурина и пиримидина. Упражнения по теме «Гетероциклические соединения» 1. Напишите схему превращений пятичленных гетероциклов по Юрьеву. 2. Объясните кислотные свойства пиррола. Напишите схему получения a-метиллпиррола из пиррола. 3. Напишите схему получения оксима фурфурола. 4. Напишите структурную формулу порфина. 5. Напишите формулы оснований – производных пурина, входящих в состав нуклеиновых кислот. 6. Напишите схему получения a-аминопиридина (реакция Чичибабина). К какому типу реакций замещения относится данная реакция? 7. Напишите схему получения β-пиридинкарбоновой кислоты (витамин РР). 8. Напишите формулы оснований – производных пиримидина, входящих в состав нуклеиновых кислот. 9. Приведите схему метаболизма триптофана в живом организме. 10. Напишите для пиридина уравнения следующих реакций с введением одной замещающей группы: а) бромирования; б) хлорирования; в) нитрования; г) сульфирования. Назовите образующиеся соединения. 11. Предложите схему синтеза противомикробного лекарственного средства фурацилина, исходя из фурфурола и используя другие необходимые реагенты. 12. Предложите пути получения 2-амино и 3-аминопиридинов, исходя из пиридина. Какое из этих аминопроизводных синтезируется по реакции Чичибабина? 13. Диэтиламид никотиновой кислоты (кордиамин) применяется в кардиологической практике. Предложите путь синтеза кордиамина, исходя из β-пиколина и используя необходимые реагенты.
Литература 1. Грандберг И.И. Органическая химия. – М.: Дрофа, 2001, с.145-190, 261-275. 2. Грандберг И.И. Практические работы и семинарские занятия по органической химии. – М.: Дрофа, 2001, с.340-345. 3. Рево А.Я., Зеленкова В.В. Малый практикум по органической химии. – М.: высшая школа, 1980. – с.47-67. 4. Швехгеймер Г.А., Кабраков К.И. Органическая химия. – М.: Высшая школа, 1984. – с.149-167.
|