Принцип формольного титрования
Поместить в пробирку 3 капли 40%-ного формалина и добавить I каплю 0,2% раствора индикатора метилового красного. Появляется красное окрашивание, указывающее, на кислую реакцию. Причина этого явления – дисмутация водных растворов формальдегида (или окислительного восстановления). С помощью тонкого запаянного стеклянного капилляра добавить очень небольшое количество 2н NaОН до нейтрализации раствора (раствор пожелтеет). Полученный нейтрализованный формалин добавить к нейтральному раствору глицина. Немедленно появляется красное окрашивание, указывающее на наличие кислоты. Блокируя аминогруппу, формальдегид одновременно освобождает карбоксильную группу, вследствие чего раствор аминокислоты приобретает кислую реакцию. Напишите уравнение реакции. При добавлении формалина нейтральные аминокислоты можно определять титрованием с помощью щелочи (формольное титрование по Зеренсену). Опыт 11.4 Цветные реакции на белки а) Биуретовая реакция. К 1 -2 мл раствора белка добавить равный объем щелочи и затем 3-4 капли медного купороса. Как изменится окраска раствора? б) Ксантопротеиновая реакция. К 1 мл раствора белка прибавить 0,2-0,3 мл азотной кислоты. Затем нагреть до кипения и кипятить 1-2 минуты. При добавлении нескольких капель аммиака как изменится окраска раствора? С помощью этой реакции обнаруживают наличие в белке ароматических ядер, т.е. остатков таких аминокислот, как фенилаланин, тирозин и триптофан. Изложить ваши наблюдения и написать структурные формулы: а) фенилаланина, тирозина и триптофана, б) образование дипептида из аланина. Опыт 11.5 Реакция на обнаружение серосодержащих аминокислот (цистин, цистеин) Налить в пробирку 3 капли раствора уксуснокислого свинца и 1-2 капли едкого натра до растворения образовавшегося осадка гидроокиси свинца. Прибавить 3-4 капли белка исмесь осторожно нагреть. Раствор начинает темнеть (выделяется осадок сернистого свинца). Вопросы для контроля 1. Классификация аминокислот. Заменимые и незаменимые аминокислоты. 2. Амфотерный характер аминокислот. 3. Химические свойства аминокислот. Отношение их к нагреванию. 4. Получение аминокислот. 5. Получение ди-, три- и полипептидов. Пептидная связь. 6. Классификация белков. Простые и сложные белки. 7. Строение белковой молекулы: первичная, вторичная, третичная и четвертичная структура белка.
Упражнения по теме «Аминокислоты. Белки» 1. Напишите все изомеры аминокислот состава С4Н9О2N (их пять). Назовите их по номенклатуре ИЮПАК. 2. Напишите реакцию изомасляной кислоты с бромом и полученного соединения с избытком аммиака. 3. Напишите уравнения реакций взаимодействия с водным раствором щелочи и с соляной кислотой следующих аминокислот: а) глицина; б) аланина; в) фенилаланина. 4. Подвергните нагреванию a-, β-, γ-аминовалериановые кислоты. Назовите полученные соединения. 5. Напишите уравнения реакций действия азотистой кислоты на: а) глицин; б) аланин; в) серин. 6. Напишите уравнение реакции декарбоксилирования следующих аминокислот: а) лизин; б) орнитин. 7. Напишите уравнения реакции гидролиза: а) аланилглицина; б) аланилаланина; в) глицилсерина. 8. Предложите схему синтеза аланина из этилового спирта. Для аминокислоты напишите уравнения реакции: а) с HCl; б) с NaOH; в) с HNO3. 9. Напишите формулы промежуточных и конечных продуктов в схеме:
10. Напишите схему следующих превращений: аланин t0 → дикетопиперазин Н2О → дипептид. 11. Дополните схему следующих превращений: 3-амино-2-метилбутановая кислота t0 → А Назовите конечный продукт. 12. Из ацетилена получите аланин. 13. Из этилена получите аланил-глицин. 14. Напишите формулы следующих трипептидов: а) аланил-глицил-серин; б) глицил-фенилаланил-аланин; в) глицил-лизил-триптофан. 15. С аланином проведите следующие реакции: а) с этиловым спиртом; б) с аммиаком; в) с гидроксидом меди.
|


 Б
Б 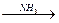 В
В


