Теоретические основы метода. Теплоемкостью тела называют количество теплоты, необходимое для нагревания или охлаждения тела на 1 К
Цель работы
Закрепление знаний по разделу курса «Теплоемкость», получение навыков экспериментального определения теплоемкости.
Теплоемкостью тела называют количество теплоты, необходимое для нагревания или охлаждения тела на 1 К. Теплоемкость единицы количества вещества называют удельной теплоемкостью. Удельной теплоемкостью вещества называют количество теплоты, которое необходимо сообщить или отнять от единицы вещества, чтобы изменить его температуру на 1 К в данном процессе. Количество газа может быть задано массой, объемом и числом киломолей. При задании газа объемом этот объем приводят к нормальным условиям (нормальные физические условия (НФУ), это условия при p = 760 мм рт.ст = 1,013 × 105 Па и t = 0 oС) и измеряют нормальными метрами кубическими (нм3). В зависимости от способа задания количества газа различают следующие теплоемкости: с – массовую теплоемкость, Дж/ (кг×К); с¢; – объемную теплоемкость, Дж/ (нм3 ×К); сm – мольную теплоемкость, Дж/(кмоль ×К). Между названными теплоемкостями существуют следующие зависимости:
где uн – удельный объем газа при нормальных условиях, rн – плотность газа при нормальных условиях, m –масса киломоля. Количество теплоты, сообщаемое рабочему телу, зависит от особенностей термодинамического процесса. Практическое значение имеют два вида теплоемкости в зависимости от термодинамического процесса: изохорная и изобарная. Теплоемкость при u = const – изохорная. cu – массовая изохорная теплоемкость, c¢u – объемная изохорная теплоемкость, cmu – мольная изохорная теплоемкость. Теплоемкость при p = const – изобарная. cр – массовая изобарная теплоемкость, c¢р – объемная изобарная теплоемкость, cmр – мольная изобарная теплоемкость. При одинаковом изменении температуры в процессе, осуществляемом при p = const, расходуется теплоты больше, чем в процессе при u = const. Это объясняется тем, что при u = const теплота, сообщаемая телу, расходуется лишь на изменение его внутренней энергии, тогда как при p = const теплота расходуется и на увеличение внутренней энергии, и на совершение работы расширения. Разность между массовой изобарной и массовой изохорной теплоемкостями по уравнению Майера:
где R – газовая постоянная, Дж/(кг× к). Если левую и правую части уравнения (2) умножить на массу киломоля m, то получим
Величину mR называют универсальной газовой постоянной, она для всех газов равна 8314Дж/(кмоль×К). Различают среднею и истинную теплоемкость. Истинная теплоемкость есть отношение бесконечно малого количества теплоты dq к бесконечно малому изменению температуры dt. Другими словами, истинная теплоемкость – это теплоемкость газа при данной температуре. Математически выражение для истинной теплоемкости запишется как
Средняя теплоемкость представляет собой отношение конечного количества теплоты q к конечному изменению температуры t2 – t1:
Обычно значения средних теплоемкостей приводятся в таблицах термодинамических свойств веществ. Однако для сокращения объема этих таблиц в них приводятся значения средних теплоемкостей, определенных в диапазоне изменения температуры от 0 оС до t оС. Среднюю теплоемкость можно вычислить по табличным средним теплоемкостям по уравнению
Количество теплоты, подведенной или отведенной от рабочего тела, можно рассчитать по какому–либо из уравнений:
В данной лабораторной работе нужно определить среднюю изобарную теплоемкость воздуха. Определение теплоемкости воздуха производится из уравнения теплового баланса калориметра, составленного для стационарного режима. При стационарном режиме все тепло, выделяемое электрическим нагревателем, полностью расходуется на нагревание воздуха, проходящего через установку, если пренебречь потерями тепла в окружающую среду. Уравнение теплового баланса калориметра:
где J – сила тока, проходящего через нагреватель; U – напряжение; τ; – время проведения опыта; С р– средняя массовая теплоемкость воздуха; t1 – температуры воздуха на входе калориметра; t2 – температуры воздуха на выходе из калориметра; M – масса воздуха, прошедшего через калориметр за время опыта τ;,
|

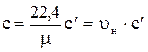 ; с¢ = с × rн,
; с¢ = с × rн,
 .
.
 .
.
 .
.


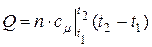 .
.



