Токи через потенциалзависимые мембранные каналы
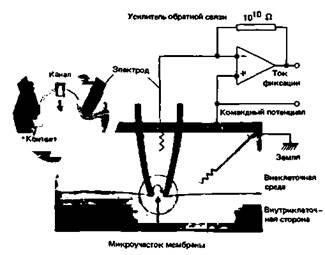
Локальная фиксация потенциала мембраны. До сих пор мы рассматривали токи и сдвиги проводимости всей мембраны при ее деполяризации. Несколько лет назад был разработан метод регистрации токов в микроучастках мембраны диаметром примерно 1 мкм, который позволяет идентифицировать молекулярные реакции одиночных каналов на основе зависимостей ионных токов от потенциала и времени. Рис. 2.11 иллюстрирует принцип локальной фиксации потенциала ("patch clamp") [12, 24]. Стеклянная микропипетка, диаметр кончика которой меньше 1 мкм, подводится к клетке вплоть до контакта с мембраной, и когда через пипетку подается отрицательное давление, пипетка обычно закупоривается участком мембраны; электрическое сопротивление между пипеткой и внеклеточным раствором возрастает скачком более чем до 1 ГОм (109 Ом). В результате микроучасток мембраны электрически изолируется от остальной мембраны. Канал пипетки соединен с усилителем обратной связи, который обеспечивает регулирующую цепь для поддержания потенциала пипетки на заданном уровне. Ток, необходимый для стабилизации потенциала-«ток фиксации»-точно соответствует току, протекающему в каждый момент через микроучасток мембраны. Командный потенциал усилителя можно устанавливать произвольно, так что регистрация токов через микроучасток мембраны может осуществляться при различных мембранных потенциалах или после ступенчатых сдвигов потенциала. Гигаомный контакт между пипеткой и мембраной настолько прочен, что после отведения пипетки микроучасток мембраны часто отрывается от клетки, оставаясь прикрепленным к кончику пипетки. В этом случае регистрацию можно производить в микроучастке мембраны, отделенном от клетки, причем цитоплазматическая поверхность этого участка может омываться любым нужным раствором. Путем искусных манипуляций микроучасток мембраны можно даже перевернуть на пипетке наружной стороной мембраны наружу. Тогда цитоплазматическую поверхность можно орошать раствором в пипетке, который должен примерно соответствовать внутриклеточной среде, а на наружную поверхность могут воздействовать растворы различного состава; такая конфигурация «наружной стороной наружу» („outside-out") очень полезна для тестирования реакций каналов мембраны на изменения состава внеклеточной среды, на медиаторы или на фармакологические средства внеклеточного действия. Достаточно прочный контакт между участком мембраны и кончиком пипетки может быть достигнут только при абсолютной чистоте стекла пипетки и мембраны. Образованию контакта могут мешать волокна соединительной ткани, которые обычно приходится удалять путем обработки мембраны такими ферментами, как коллагеназа [12]. 36 ЧАСТЬ I ОБЩАЯ ФИЗИОЛОГИЯ КЛЕТКИ
Токи через одиночные Na+-каналы. Токи через микроучасток мембраны, процедура регистрации которых показана на рис. 2.11, схематически представлены на рис. 2.12. Слева приведены 10 записей Na+-тока, при каждой из которых мембрана была деполяризована на период 14 мс. В каждом случае наблюдается только единственный короткий импульс тока с амплитудой —1,6 пА; это ток, протекающий через одиночную белковую молекулу Na+-канала. Длительность импульсов тока, которая соответствует времени открытого состояния канала, значительно варьирует около среднего значения 0,7 мс. Моменты открывания также варьируют, но при суммировании многих одиночных отведений получается результирующий временной ход тока, который на рис. 2.12 вверху слева изображен под записью скачка потенциала. Судя по записи временного хода тока, вероятность открывания канала резко возрастает при деполяризации, достигает максимума через 1,5 мс, затем снижается и становится минимальной через 10 мс после скачка деполяризации. Такое уменьшение вероятности открывания канала после деполяризации соответствует инактивации суммарного Na+-TOKa [8, 31]. Отсюда следует, что открывание Na+-каналов при деполяризации не является строго детерминированным процессом; скорее происходит повышение вероятности открывания канала, а после того как он открылся, существует определенная вероятность, что он снова закроется. Таким «стохастическим» поведением обладают химические реакции, так что различные состояния канала - «закрытое, но способное к активации», «открытое» и «закрытое инактивированное» (неспособное к активации) можно связать между собой посредством постоянных скорости, как и в случае химических реакций. Простейшая модель поведения Na+-канала включает эти три состояния (рис. 2.13). Переход от закрытого и способного к активации в открытое состояние обеспечивается деполяризацией. Однако деполяризация ускоряет также и переход в инактивированное состояние, поэтому открытый канал подвергается быстрой инактивации и остается инактивированным, пока в результате ре- или гиперполяризации мембраны не вернется в закрытое, но способное к активации состояние. Равновесие между закрытым, но способным к активации и закрытым инактивированным состояниями тоже устанавливается посредством мембранного потенциала; это соотношение проявляется в виде зависимости от исходного потенциала способности Na+-TOKa к активации (рис. 2.8) [8]. Токи через одиночные К+-каналы. На рис. 2.12 справа схематически представлены токи одиночных К+-каналов, аналогично токам Na+-KaHaлов (см. слева). Импульсы тока тоже имеют маленькую амплитуду (всего лишь +2 пА), а продолжительность открытого состояния канала варьирует вблизи среднего значения 5 мс. Однако в период открытого состояния К+-канал часто на короткое время закрывается, т. е. происходят быстрые осцилляции между открытым и закрытым состояниями. Такие «вспышки» открываний наблюдаются для многих типов каналов (с. 39 и 65). В отличие от Na+-канала, К +-канал не инактивируется во время деполяризации; пока продолжается деполяризация, индивидуальные каналы непрерывно открываются и закрываются. В соответствии с этим, при суммации отведений получается кривая К+-тока, которая нарастает до стационарного уровня. Таким образом, описывая поведение токов К+-каналов с помощью модели, представленной на рис. 2.13, следует отметить, что инактивированное состояние в данном случае отсутствует, но наблюдаются два последовательных закрытых состояния, которые обеспечивают прерывистый характер вспышек [34] (см. Ca2+-канал). Рис. 2.12 отражает поведение К+-каналов, типичное для нервных волокон: задержанное нарастание суммарного тока при деполяризации, заметное повышение проводимости во время деполяризации от ГЛАВА 2. ПЕРЕДАЧА ИНФОРМАЦИИ ПОСРЕДСТВОМ ВОЗБУЖДЕНИЯ 37
потенциала покоя и отсутствие инактивации (ср. рис. 2.6). Обнаружено по крайней мере пять других типов К+-каналов. Они различаются, например, соотношением между открыванием канала и потенциалом мембраны, характеристиками инактивации (см. рис. 2.25) или же зависимостью не только от деполяризации, но и от внутриклеточной концентрации Са2+. Эти типы К+-каналов обнаружены в клетках различных типов или частях клетки и присутствуют либо по отдельности, либо в виде определенных сочетаний. Именно разнообразие К+-каналов обусловливает вариации формы потенциалов действия, а также различную скорость реполяризации и особенности следовых потенциалов (см. рис. 2.4). Существует яркий контраст между многообразием К+-каналов и одновременно Na+-каналов, которые в возбудимых клетках животных всех типов быстро активируются деполяризацией, а затем быстро инактивируются. Токи через одиночные Ca2 + -каналы. До сих пор мы не упоминали о том, что при деполяризации клетки открываются также Ca2+-каналы. При этом возникает входящий кальциевый ток,который вместе с одновременно развивающимся Na+-током обеспечивает деполяризацию мембраны. Концентрация свободных ионов Са+ в клетке очень низка (табл. 1.1), так что равновесный потенциал для Ca2 + более положителен, чем ENa (гл. 1, уравнение 4, с. 13). В аксонной мембране gCa меньше по сравнению с gNa, поэтому этой величиной можно пренебречь при анализе потенциала действия (рис. 2.7). Однако в дендритах нейронов или в окончаниях аксонов (см. с. 62) во время деполяризации gCa может возрастать, превышая gNa. В миокарде и тем более в гладких мышцах повышение gCa бывает столь же велико, как и повышение gNa, а иногда и более значительно. Такие входящие токи Са2+ представляют особый интерес из-за их влияния на внутриклеточную концентрацию Са2+, [Са2+]i , которая может возрастать с 10−7 до 10−6 М; это повышение [Са2 + ]; часто выполняет в клетке регулирующие функции (см. с. 23 и рис. 1.16). Механизм открывания Ca2+-каналов и последующие внутриклеточные процессы являются филогенетически очень древними - они выявлены даже у простейших.
|