Строение молекулы гемоглобина
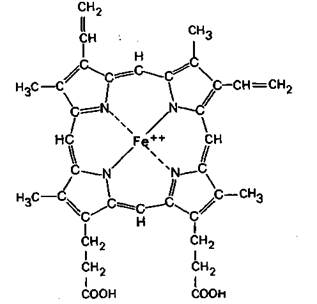
Одна из важнейших функций крови состоит в переносе поглощаемого в легких кислорода к органам и тканям, а также в удалении образующегося в них диоксида углерода и переносе его в легкие. Ключевую роль во всех этих процессах играют эритроциты. Эти клетки содержат красный пигмент крови -гемоглобин, способный соединяться с кислородом в капиллярах легких и высвобождать его в капиллярах тканей. Кроме того, гемоглобин способен связывать некоторое количество диоксида углерода, образующегося в процессе клеточного метаболизма, и высвобождать его в легких. В связи с этим гемоглобин играет важнейшую роль в переносе дыхательных газов. Гемоглобин относится к классу белков-хромопротеинов. Его молекула состоит из четырех полипептидных цепей, с каждой из которых нековалентно связана особая пигментная группа —гем. Молекулярная масса гемоглобина составляет около 64500, а каждой из его субъединиц-16000 [2, 7, 18]. Пигментные группы гемоглобина. В состав молекулы гемоглобина входят четыре одинаковые гемовые группы. Гем представляет собой протопорфирин, содержащий центрально расположенный ион двухвалентного железа. Молекула протопорфирина состоит из четырех пиррольных колец, связанных метиновыми мостиками; к кольцам присоединены боковые цепи характерного строения (рис. 22.1). Ключевую роль в активности гемоглобина играет ион железа, расположенный в центре молекулы протопорфирина. Соединение с этим ионом посредством двух координационных связей и двух связей, образовавшихся вследствие замещения водорода, превращает протопорфирин в гем. Структура гема целиком расположена в одной плоскости. В процессе переноса кислорода гемоглобином молекула О2 обратимо связывается с гемом, при этом валентность железа не изменяется. Присоединяя кислород, гемоглобин (Hb) превращается в оксигемоглобин (НЬО2). Чтобы подчеркнуть тот факт, что валентность железа при этом связывании не меняется, реакцию называют не окислением, а оксигенацией; обратный процесс называется дезоксигенацией. Когда хотят специально отметить, что гемоглобин не связан с кислородом, его называют дезоксигемоглобином. Гем может подвергаться не только оксигенации, но и истинному окислению. При этом железо становится из двухвалентного трехвалентным (рис. 22.2). Окисленный гем называется гематином (метгемом), а вся полипептидная молекула в целом метгемоглобином. В крови человека метгемоглобин содержится в незначительных количествах, но при некоторых заболеваниях и отравлениях определенными ядами его содержание возрастает. Опасность таких состояний заключается в том, что окисленный гемоглобин не способен переносить кислород к тканям.
606 ЧАСТЬ VI. ДЫХАНИЕ
Белковый компонент гемоглобина. Большая часть молекулы гемоглобина, состоящей примерно из 10000 атомов, приходится на долю белкового компонента. Этот компонент состоит из четырех отдельных полипептидных цепей, в состав каждой из которых входит более 140 аминокислотных остатков. Путем химического анализа установлены аминокислотные последовательности полипептидных цепей гемоглобина. В последние годы при помощи рентгеноструктурного анализа было установлено пространственное расположение этих цепей [26, 27]. На рис. 22.3 изображена модель молекулы гемоглобина, созданная на основе результатов указанных исследований. Она состоит из двух симметричных «светлых» цепей, тесно переплетенных с двумя симметричными «темными» цепями. Вся молекула имеет приблизительно сферическую форму. Гемовые группы, изображенные в виде красных дисков, располагаются в нишах вблизи поверхности. В гемоглобине взрослого человека (НbА) светлые субъ-
единицы, каждая из которых содержит 141 аминокислотный остаток, называются а-цепями. а темные субъединицы (по 146 аминокислотных остатков)ß-цепями. В составе фетального гемоглобина (HbF) вместо ß-цепей имеются две так называемые γ-цепи, отличающиеся по аминокислотной последовательности. Вскоре после рождения HbF заменяется на НbА [2].
|