Буферные свойства крови
Общее понятие о буферных системах. Прежде всего необходимо вспомнить, что реакции диссоциации слабой кислоты НА на ионы водорода Н+ и сопряженное основание А− подчиняются закону действующих масс. Кинетику таких реакций описывает уравнение
618 ЧАСТЬ VI. ДЫХАНИЕ где величины, приведенные в квадратных скобках,молярные концентрации веществ, участвующих в реакции; К'- константа равновесия, или диссоциации (знак ' означает, что данная величина вычислена с учетом особых параметров раствора, например ионной силы). Если содержание ионов Н+ повышается, то для сохранения равновесия в соответствии с законом действующих масс должна увеличиваться и концентрация недиссоциированной кислоты. Это означает, что степень диссоциации кислоты несколько уменьшается, и происходит связывание свободных ионов Н +, добавленных в раствор. В результате pH изменяется меньше, чем следовало бы ожидать, исходя из количества добавленных ионов Н +. Столь же незначительные сдвиги pH происходят и при снижении [Н+]. Нивелировка влияния добавленных в раствор ионов Н* или ОН~ называется буферным эффектом. Для количественной оценки буферного эффекта можно прологарифмировать уравнение (13) и взять отрицательные логарифмы всех величин: (И)
Подобное уравнение для буферных систем, выведенное из закона действующих масс, называется уравнением Гендерсона-Гассельбальха. Величина рК', так же как и К',-константа, характеризующая свойства системы (рК'= —lg К'). Уравнение (15) можно представить в следующем виде:
где
Величина а, называемая степенью диссоциации, равна отношению концентрации сопряженного основания [А−] к сумме концентраций кислоты и основания ([НА] + [А−]). Кривая, представленная на рис. 22.11, отражает зависимость между степенью диссоциации α и pH буферного раствора. Из этой кривой видно, что степень диссоциации может изменяться лишь в ограниченных пределах pH, равных рК' ±2. Буферные свойства раствора проявляются лишь в этих пределах pH. Показателем способности системы, состоящей из слабой кислоты и сопряженного основания, создавать буферный эффект служит буферная емкость величина, равная соотношению между количеством ионов Η + или ОН−, добавленных в раствор, и изменением pH. Буферная емкость наиболее высока в области крутого наклона буферной кривой и мак- симальна при pH = рК' (рис. 20.11). Таким образом, буферная емкость раствора зависит от его концентрации и от разницы между ρ Η и рК' этого раствора. Бикарбонатный буфер. Из имеющихся в крови буферных систем рассмотрим прежде всего бикарбонатную систему. Она включает относительно слабую угольную кислоту, образующуюся при гидратации СО2, и бикарбонат в качестве сопряженного основания:
Уравнение Гендерсона-Гассельбальха для суммарной реакции имеет следующий вид:
Величину [СО2] можно заменить величиной напряжения СО2 (РСо):
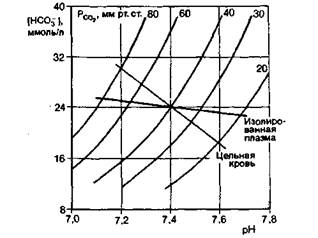
Размерность коэффициента 0,03 - это ммоль x л−1 x мм рт.ст.−1, поэтому его можно использовать лишь тогда, когда [HCO3−] выражена в единицах ммоль/л, а Р CO2- в мм рт.ст. При ионной силе плазмы рК' составляет 6,1. Казалось бы. при таком различии между рК' и pH крови (7,4) емкость бикарбонатного буфера должна быть невелика. Однако на самом деле бикарбонатная система играет большую роль в создании общей буферной емкости крови, так как буферный эффект этой системы существенно увеличивается благодаря ее тесной связи с дыханием. Механизмы, направленные на поддержание напряжения СО2 в артериальной крови (40 мм рт. ст.), способствуют созданию высокой концентрации НСО3− в плазме (24 ммоль/л). Иными словами, регулируя напряжение СО2 в крови, дыхательная система обеспечивает высокое содержание компонентов буферной системы. Кроме того, органы дыхания вместе с бикарбонатным буфером образуют «открытую систему», в которой напряжение СО2 (а следовательно, и pH крови) может регулироваться путем изменения вентиляции легких. Фосфатный буфер. В фосфатной буферной системе, образованной неорганическими фосфатами крови, роль кислоты играет одноосновный фосфат Н2РО 4−, а роль сопряженного основания-двухосновный фосфат НРО 24−. Величина рК' фосфатного буфера (6,8) сравнительно близка к pH крови, однако емкость данного буфера невелика по причине низкого содержания фосфата в крови. Белковый буфер. Буферные свойства белков кро- ГЛАВА 22. ТРАНСПОРТ ГАЗОВ КРОВИ 619 ви обусловлены способностью аминокислот ионизироваться. Концевые карбокси- и аминогруппы белковых цепей играют в этом отношении незначительную роль, так как таких групп мало и их рК' существенно отличаются от pH крови. Значительно больший вклад в создание буферной емкости белковой системы вносят боковые группы, способные ионизироваться, и особенно имидазольное кольцо гистидина. К буферным белкам относятся как белки плазмы (в частности, альбумин), так и содержащийся в эритроцитах гемоглобин. На долю последнего приходится большая часть буферной емкости белковой системы, что связано как со значительной концентрацией гемоглобина, так и с относительно высоким содержанием в нем гистидина. Особенно наглядно роль гемоглобина в создании буферной емкости крови можно показать, если сравнить сдвиги pH в ллазме и цельной крови, вызываемые одинаковыми изменениями напряжения СО2. Результаты такого сравнения удобно представить в виде графика зависимости pH от [HCO3− ], на который нанесены кривые для постоянного напряжения СО2, рассчитанные в соответствии с уравнением Гендерсона-Гассельбальха [уравнение (19)]. Измерив при разных значениях напряжения СО2 pH и содержание HCO3− в плазме и в цельной крови, где происходит обмен ионов между плазмой и эритроцитами, строят так называемые равновесные кривые СО2 для изолированной плазмы и цельной крови (рис. 22.12). Чем круче наклон кривой для цельной крови, тем больший вклад вносит в буферную емкость крови гемоглобин, и чем больше угол наклона кривой буферной емкости, тем меньше изменения pH при данном увеличении или уменьшении напряжения СО2 .
Гемоглобин играет также важную роль в буферной емкости крови благодаря изменению его кислотных свойств при оксигенации и дезоксигенации. Эта зависимость выражена на рис. 22.13, где приведены буферные кривые (кривые титрования) для недиффундирующих буферных систем эритроцита на основе гемоглобина в оксигенированном и дезоксигенированном состояниях. Видно, что в физиологическом диапазоне pH оксигемоглобин является более сильной кислотой, чем дезоксигемоглобин. Такая разница обусловлена главным образом влиянием кислорода, связанного с железом, на связывание Н + соседними имидазольными группами гистидина. Благодаря этому влиянию гемоглобин, освобождая в тканях кислород, приобретает большую способность к связыванию ионов Η+, образующихся при одновременном поглощении СО2. При поглощении кислорода кровью в легких происходят обратные процессы. Таким образом, обмен О2 усиливает буферный эффект гемоглобина. Буферные основания. Буферные свойства крови обусловлены суммарным эффектом всех анионных 620 ЧАСТЬ VI. ДЫХАНИЕ групп слабых кислот; важнейшими из них являются бикарбонат и анионные группы белков («протеинаты»). Все эти анионы, обладающие буферными эффектами, называют буферными основаниями (по международной номенклатуре-buffer bases, BB) [10]. На рис. 22.14 приведены концентрации различных ионов в плазме, эритроцитах и цельной крови человека (для артериальной крови). Высота столбиков пропорциональна концентрации ионов. Верхняя часть столбиков, относящихся к анионам, соответствует буферным основаниям (темно-красный цвет), а нижняя часть-всем анионам сильных кислот (кроме Сl−), не обладающих буферными свойствами, таким как SO42− и органические анионы (обозначенные вместе Х~). Из рисунка видно, что в плазме основную часть буферных оснований составляют ионы НСО3−, а в эритроцитах-протеинаты. В цельной крови более чем 1/3 всех анионов обладают буферным действием. Концентрация буферных оснований в артериальной крови составляет примерно 48 ммоль/л. Очень важно, что эта величина не изменяется при сдвигах напряжения СО2. Рассмотрим причины такого постоянства. Предположим, например, что напряжение СО2 возрастает. При этом образуются равные количества Н+ и HCO3−. Ионы Н+ почти полностью связываются протеинатами, переходящими при этом в недиссоциированную форму. В результате концентрация протеинатов снижается настолько, насколько увеличивается концентрация бикарбоната (рис. 22.15).
Подобные концентрационные сдвиги в буферных системах не взаимоуравновешиваются полностью, так как некоторые протоны остаются в свободной форме, изменяя тем самым pH. Так, если P CO2возрастает от 40 до 50 мм рт. ст., то pH внутри эритроцитов снижается на 0,06, а в плазме- на 0,1. Это означает, что концентрация ионов Н+ увеличивается примерно на 10−5 ммоль/л. Однако этот сдвиг очень мал и не влияет на характер графика, приведенного на рис. 22.15. Поскольку суммарная концентрация буферных оснований крови не зависит от Р CO2, по ней можно судить о сдвигах кислотно-щелочного равновесия, вызванных увеличением или уменьшением содержания нелетучих кислот в крови. Отклонение концентрации буферных оснований от нормального уровня (48 ммоль/л) называется избытком оснований (по международной номенклатуре-base excess, BE). Таким образом, в норме BE по определению равен нулю. При патологическом увеличении содержания буферных оснований BE становится положительным, а при снижении - отрицательным. В последнем случае можно использовать термин «дефицит оснований»,так как выражение «отрицательный избыток оснований» с семантической точки зрения бессмысленно.
|

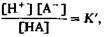 (13)
(13) (15)
(15)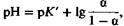 (16)
(16)
 • (Π)
• (Π) (18)
(18) (19)
(19)