Высокомолекулярные продукты конденсации
Среди высокомолекулярных продуктов конденсации важное значение приобрели конденсационные смолы в виде лаковых покрытий и всевозможных бытовых и технических пластмассовых изделий. В качестве примера можно привести схему получения фенолформальдегидных смол. Этот тип смол получают поликонденсацией фенола с формальдегидом в присутствии кислот или щелочей, играющих роль катализаторов. Поликонденсация протекает через ряд промежуточных реакций. Вначале образуется растворимый полимер линейной структуры со сравнительно небольшим молекулярным весом (I). Линейные растворимые полимеры при более глубоком процессе поликонденсации способны переходить в трехмерные – пространственные полимеры, неплавкие и не растворимые (I):
(I) линейная форма (смола растворяется) Такого рода смолы получают в больших количествах; их применяют в производстве очень ценных деталей машин, аппаратов, приборов, бытовых изделий и пр.
В животные организмы белки поступают в готовом виде – с растительной или животной пищей. В процессе пищеварения они под влиянием ферментов расщепляются на аминокислоты, которые усваиваются, и затем в тканях, также под действием ферментов, вновь образуют белки.
пептидной связью. Гипотезу Данилевского немецкий ученый Фишер позднее развил в полипептидную теорию строения белков. Согласно этой теории, в белковых молекулах имеются полипептидные цепи различной длины, а образование полипептидной цепи можно изобразить следующей схемой:

полипептидная цепь белковой молекулы Полипептидные цепи белков строятся из десятков и сотен молекул, причем не, одной, а различных аминокислот. Образуя цепь, они могут соединяться друг с другом в различной последовательности, что приводит к огромному многообразию молекул белков. Подсчитано, что с цепью из 20 разных аминокислот (при условии, что каждая войдет в цепь только один раз) возможно гигантское число различных полипептидов—2,3 ∙ 1018. Установлено, что природа и свойства белка определяются не только тем, какие аминокислоты входят в его состав, но особенно и тем, в какой последовательности они соединяются друг с другом. Строение белковых молекул усложняется в полипептидных цепях боковыми ответвлениями (R) и ионогенными группами (— СООН, — NH2), обусловливающими амфотерность. Некоторые белки растворимы в воде и в разбавленных растворах щелочей, кислот и солей. Растворы многих белков нестойки против действия тепла: нагревание денатурирует многие белки и переводит их в нерастворимую форму (например, яичный белок). Белки осаждаются из растворов электролитами, спиртом и ацетоном. Фишер с сотрудниками, пытаясь получить белок синтетическим путем, связывал молекулы аминокислот так, чтобы аминогруппа одной молекулы вступила в реакцию с карбоксилом другой. Эту реакцию удалось осуществить также при действии аминокислот на их хлорангидриды по следующей схеме:
Аналогично могут быть получены трипептиды и полипептиды.
Полипептидные цепи или закручиваются в спираль, витки которой закреплены внутримолекулярными водородными связями, или не образуют спиралей, а располагаются параллельно, в виде лент (рис. 1). Свойства белка обусловлены пространственным строением его макромолекул. По форме макромолекул белки делятся на фибриллярные и глобулярные. Фибриллярные белки состоят из макромолекул, имеющих вид тонких вытянутых нитей. В эту группу входят белки мышечных тканей и кожных покровов, белки волос, шерсти, шелка. При комнатной температуре эти белки нерастворимы в воде, но могут набухать в ней. При повышенной температуре некоторые из них (желатин) растворяются с образованием очень вязких растворов. Глобулярные белки состоят из макромолекул эллипсоидальной, реже шаровидной формы. Они хорошо растворимы в воде, причем вязкость их растворов невелика. К ним относятся белки крови, молока. Наличие в макромолекулах белков двух ионогенных групп: основной —NH2 и кислотной —СООН сообщает белкам как уже сообщалось амфотерные свойства. В водных растворах макромолекула белка может диссоциировать как кислота:
и как основание: H3N-R-COOH + Н2О ⇄ H3N+-R-COOH + OH- В кислой среде, содержащей избыток водородных ионов, ионизация карбоксильных групп будет подавлена и макромолекула белка приобретает, положительный - заряд в результате следующей реакции: H3N+—R—СООН + ОН- + Н+ + Сl- → H3N+—R-COOH + Сl- + Н2О В щелочной среде белок ведет себя как кислота: H2N—R-COO- + Н+ + ОН- + К+ → H2N-R-COO- + К+ + Н2О и макромолекула белка будет приобретать отрицательный заряд. Очевидно, должна существовать такая концентрация ионов водорода, при которой число ионизированных основных групп равно числу ионизированных кислотных групп, при этом число как тех, так и других групп должно быть минимальным. Такое состояние белка, при котором число ионизированных основных и кислотных групп в молекуле одинаково, называется изоэлектри-ческим состоянием, а значение рН, которое соответствует изо-электрическому состоянию, называется изоэлектрической точкой -белка. Большинство природных белков содержит значительные количества дикарбоновых аминокислот, т. е. кислот с двумя карбоксильными группами. Поэтому эти белки являются более сильными кислотами, чем основаниями. Изоэлектрическая точка таких белков находится в области рН ниже 7 и для ее достижения в раствор белка нужно ввести некоторое количество кислоты для подавления ионизации карбоксильных групп.
|


 Белковые вещества, или белки, представляют собой высокомолекулярные органические соединения, сложные молекулы которых построены из аминокислот. Значение белков в природе исключительно велико, так как они играют первостепенную роль во всех явлениях жизни. Белки широко распространены в природе; это основные вещества, из которых построены ядра и протоплазма живых клеток, мышцы, хрящи, сухожилия и кожа, волосы. Они содержатся также в растениях, которые, наряду с синтезом углеводородов, осуществляют синтез белков из простых неорганических веществ.
Белковые вещества, или белки, представляют собой высокомолекулярные органические соединения, сложные молекулы которых построены из аминокислот. Значение белков в природе исключительно велико, так как они играют первостепенную роль во всех явлениях жизни. Белки широко распространены в природе; это основные вещества, из которых построены ядра и протоплазма живых клеток, мышцы, хрящи, сухожилия и кожа, волосы. Они содержатся также в растениях, которые, наряду с синтезом углеводородов, осуществляют синтез белков из простых неорганических веществ.
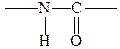 В продуктах распада природных белков были обнаружены различные аминокислоты. Еще в 1888 г. Данилевский высказал гипотезу о том, что различные аминокислоты, образуя белки, соединяются за счет амино- и карбоксильных групп с образованием группировки, впоследствии названной
В продуктах распада природных белков были обнаружены различные аминокислоты. Еще в 1888 г. Данилевский высказал гипотезу о том, что различные аминокислоты, образуя белки, соединяются за счет амино- и карбоксильных групп с образованием группировки, впоследствии названной


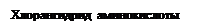

 Белки в зависимости от формы молекулы разделяются на фибриллярные, имеющие линейную, вытянутую форму молекулы, и глобулярные, имеющие свернутые — шаровидные молекулы — глобулы. Молекулярная масса белков колеблется в очень широких пределах — от 17500 для лактальбумина до 6800000 для гемоцианина.
Белки в зависимости от формы молекулы разделяются на фибриллярные, имеющие линейную, вытянутую форму молекулы, и глобулярные, имеющие свернутые — шаровидные молекулы — глобулы. Молекулярная масса белков колеблется в очень широких пределах — от 17500 для лактальбумина до 6800000 для гемоцианина.
 От реакции среды и, характера диссоциации белковой макромолекулы зависит форма ее в растворе. При диссоциации только •по кислотному или только по основному типу в макромолекулярнои изогнутой гибкой цепи появятся одноименные заряды, распределенные по всей ее длине. Под действием сил электростатического отталкивания положительных или отрицательных зарядов макромолекула растягивается. В изоэлектрическом состоянии в макромолекуле чередуются разноименно заряженные группы, которые притягиваются друг к другу и тем самым сжимают или даже скручивают макромолекулу (рис.2).
От реакции среды и, характера диссоциации белковой макромолекулы зависит форма ее в растворе. При диссоциации только •по кислотному или только по основному типу в макромолекулярнои изогнутой гибкой цепи появятся одноименные заряды, распределенные по всей ее длине. Под действием сил электростатического отталкивания положительных или отрицательных зарядов макромолекула растягивается. В изоэлектрическом состоянии в макромолекуле чередуются разноименно заряженные группы, которые притягиваются друг к другу и тем самым сжимают или даже скручивают макромолекулу (рис.2). Изменение формы макромолекулы белка в зависимости от реакции среды определяет свойства белковых растворов. В изоэлектрическом состоянии молекулы белка свернуты в плотный клубок и занимают небольшой объем. С увеличением или уменьшением рН молекулы распрямляются и объем клубка увеличивается. Чем
Изменение формы макромолекулы белка в зависимости от реакции среды определяет свойства белковых растворов. В изоэлектрическом состоянии молекулы белка свернуты в плотный клубок и занимают небольшой объем. С увеличением или уменьшением рН молекулы распрямляются и объем клубка увеличивается. Чем  больший объем занимает макромолекула, тем в большей степени она препятствует течению жидкости, т. е. в большей степени увеличивается вязкость. По изменению вязкости раствора белка в зависимости от рН можно найти изоэлектрическую точку белка; ей соответствует минимальное значение вязкости (рис. 3). Аналогичный характер имеет также зависимость степени набухания белка от рН среды. Степень набухания минимальна в изоэлектрической точке.
больший объем занимает макромолекула, тем в большей степени она препятствует течению жидкости, т. е. в большей степени увеличивается вязкость. По изменению вязкости раствора белка в зависимости от рН можно найти изоэлектрическую точку белка; ей соответствует минимальное значение вязкости (рис. 3). Аналогичный характер имеет также зависимость степени набухания белка от рН среды. Степень набухания минимальна в изоэлектрической точке. Из синтетических аналогов белков важнейшее значение имеют полиамиды, применяемые в производстве синтетических волокон: капрона, анида, энанта, нейлона и др. Весьма ценны для синтеза полиамидов работы Кнунянца, Несмеянова, Коршака, Роговина и других ученых.
Из синтетических аналогов белков важнейшее значение имеют полиамиды, применяемые в производстве синтетических волокон: капрона, анида, энанта, нейлона и др. Весьма ценны для синтеза полиамидов работы Кнунянца, Несмеянова, Коршака, Роговина и других ученых.


