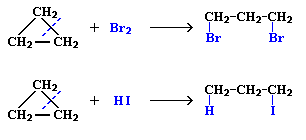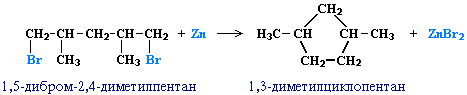Этилен(C2H4).
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур. Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы (малые циклы), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 109°28’, свойственного sp3-гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения, проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду: циклопропан > циклобутан >> циклопентан. Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения. Малые циклы (С3 – С4) довольно легко вступают в реакции гидрирования:
Циклопропан и его производные присоединяют галогены и галогеноводороды:
В других циклах (начиная с С5) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения.
Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С3Н6, метилциклопропан С4Н8, этилциклопропан С5Н10 и т.д.
1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий - нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7. 2. Действие активных металлов на дигалогензамещенные алканы (внутримолекулярная реакция Вюрца) приводит к образованию различных циклоалканов:
(вместо металлического натрия часто используется порошкообразный цинк). Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1,3-диметилциклопентана следует использовать 1,5-дигалоген-2,4-диметилпентан:
Важным промышленным способом получения циклоалканов С5 и С6 является реакция дегидроциклизации алканов. Существуют и другие методы получения циклоалканов. Так, например, циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
Этилен(C2H4). Угл.с общ.формулой CnH2n,в мол.которых между атомами угл.имеется одна двойная связь, наз.угл.ряда этилена,или алкенами. В мол.этилена одна из двойной связи легко разрыв., а явл.более прочной. (обесц.этилена). H2C=CH2 + Br2àBrH2C—CH2Br(1,2-дибромэтан). (sp2-гибридизация).4 sigma-связи и 1 pi-связь. pi-связь знач.слабее,под возд.реагентов л.разрыв. (изомерия).бутан.1)CH2=CH—CH2—CH3(1-бутен). 2)CH3—CH=CH—CH3(2-бутен). CH3—CH—CH3(2-метилпропан)àCH2=C—CH3 CH3 CH3 (2-метилпропен). (Изомеры 2-метилбутана).1)CH2=C—CH2—CH3 (2-метил-1-бутен).И так далее.Получение: 1.C2H5OH—t>140,H2SO4àC2H4+H2O(лаб.). 2.2CH4—550-650,кат.àC2H4+2H2(дег.). 3.CH3—CH3—500,NiàC2H4+H2(дег.). 4.CH2Br—CHBr—CH3(1,2-дибромметан).+ZnàC3H6+ZnBr2(пром.). 5.CH2Cl—CH2—CH3(1-хлорпропан).+KOH—tàC3H6+KCl+H2O Хим.свойства:р.присоед.: 1.H2C=CH2+Br2àCH2Br—CH2Br(1,2-дибромэтан). 2.C2H4+H2—t,кат.àC2H6 3.C2H4+HOH—t,кат.àC2H5OH(эт.спирт). 4.C2H4+HBràCH3—CH2Br(этилбромид). Вод.присоед.к наиб.,а атом галогена-к наим.гидр.атому угл. CH2=CH—CH3+HBràCH3—CHBr—CH3(2-бромпропан). Р.окисл.:C2H4+3O2à2CO2+2H2O C2H4+O+H2O—KmnO4àHO—CH2—CH2—OH(этиленгликоль). 2CH2=CH2+O2—150-350,кат.à2CH2—CH2 O Р.пол.: nCH2=CH2—кат.à(--CH2—CH2—)n(полэтилен). Процесс соед.многих одинак.мол.в более крупные наз.р.пол. (Ц.алканы-CnH2n). Реакции присоединения. Циклопропан + H2—50-70,PtàCH3—CH2—CH3 Циклопентан + H2—350,PtàCH3—CH2—CH2—CH2—CH3 Циклопропан + Br—tàCH2—CH2—CH2(1,3-дибромпропан). Br Br Циклопентан + Br2à CH2 H2C CH2—Br + HBr(бром-циклопентан). H2C CH2 Циклогексан + Cl2—tàHCl + H Cl (монохлорциколгексан) (реакция C зам.). H2C CH2(хар.для б.ц.). H2C CH2 CH2 Циклогексан –300,Ptà CH + 3H HC CH HC CH CH Получение:можно выделить из нефти, реакция Вюрца CH2—CH2—Cl H2C + 2Naàциклопентан + 2NaCl CH2—CH2—Cl Нах.в природе:входят в сост.нефти,эфирных масел. Растворяются в аром.угл. Ц.гексан и м.ц.гексан прим.для синтеза мед.,красок. Ц.пропан прим.для наркоза. Непредельные угл. CnH2n + H2—t,кат.àCnH2n+2 CnH2n-2 + 2H2—t,кат.àCnH2n+2
|