Розділ 3
Будова речовини. Будова атома та його електронних оболонок. Періодичний закон Д.І.Менделеєва та його тлумачення на основі електронної будови атомів. Хімічний зв’язок та будова молекул
Еталони розв’язання типових задач
Задача 1. Зобразити електронно–графічні формули (орбітальні структури) атома хлору в нормальному та збуджених станах. Визначити можливі валентності та ступені окислення. Написати формули можливих сполук з оксигеном та гідрогеном. Відповідь: 1s2 2s22p6 3s23p5
Валентність = І Валентність = ІІІ Валентність = V Ст. окисл. = –1 +1 +3 +5 HCl; Сl2O (Сl2O3) (Cl2O5)
Валентність = VII Ст. окисл. = +7 +7 Cl2O7 Завдання 2. Напишіть енергетичну схему заповнення електронами МО в молекулі водню. Розв’язання:
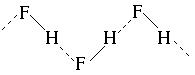
Завдання 3. Показати водневий зв’язок між молекулами фтороводню. Розв’язання:
Розділ 4 Вчення про розчини Способи вираження концентрації розчинів. Колігативні властивості розчинів. Осмос.
Еталони розв’язання типових задач
Таблиця зв’язку вираження різних способів концентрацій
Задача 1. Скільки грам борної; кислоти та води потрібно для приготування 250г розчину з масовою часткою борної кислоти 3%? Розв’язання: Формула розрахунку масової частки:
Звідси:
Води потрібно взяти: 250 – 7,5 = 242,5г
Задача 2. Скільки грамів хлориду натрію потрібно для приготування 1л розчину з СМ = 2моль/л? Розв’язання: Формула розрахунку молярної концентрації:
Задача 3. Скільки грамів КМnО4 необхідно для приготування 2л розчину з Сн = 0,5 моль/л, якщо аналіз проводиться в кислому середовищі? Розв’язання:
Задача 4. Розрахувати моляльну концентрацію розчину, приготовленого з 2г КОН і 200г води. Розв’язання: Формула розрахунку моляльної концентрації:
Задача 5. Розрахувати титр розчину сірчаної кислоти з w = 50% і r = 1,4г/мл. Розв’язання: Формула розрахунку титра розчину:
Задача 6. Знайти молярну концентрацію еквівалента розчину сірчаної кислоти з масовою часткою 10% (густина 1,22, fекв. =1/2). Розв’язання: Формула переходу від масової частки до молярной концентрації еквівалента:
Задача 7 Яка масова частка у відсотках сульфату заліза (II) у насиченому при 80 °С розчині, якщо розчинність солі при цій температурі дорівнює 100 г. Розв’язання: Коефіцієнт розчинності (розчинність) виражає кількість грамів розчиненої речовини, що міститься у 100 г розчинника (Н2О). 1. Знаходимо масу розчину: m(розчину) = m(речовини) + m(розчинника) m(розчину) = 100 г + 100 г = 200 г 2. Обчислюємо масову частку розчиненої речовини у відсотках: 200 г розчину — 100 г FеSО4 100 г розчину — X г FеSО4 X = 50 г Відповідь: масова частка сульфату заліза (II) дорівнює 50 %.
Задача 8. Обчислити об’єм розчину з масовою часткою сірчаної кислоти 56% (r = 1,460 г/мл) та об’єм води, які необхідні для приготування 100мл розчину з масовою часткою сірчаної кислоти 20% (r = 1,143 г/мл). Розв’язок: При змішуванні розчинів користуються „правилом хреста” або „діагональною схемою”. В середині хреста записують масову частку розчину (w3), який необхідно приготувати. Зліва записують концентрації w1 і w2. Справа записують різницю між w3 і w2, w3 і w1.
Згідно зі схемою на 20 в.ч. розчину з w = 5б%, необхідно взяти 36 в.ч. води, а маса розчину складає:
що згідно зі схемою складає 20+36=56 в.ч. Масу сірчаної кислоти, яку потрібно взяти для приготування розчину, можна знайти за пропорцією:
а об’єм отриманого розчину: Для приготування розчину необхідно води:
Приготування розчину розведенням більш концентрованого розчину. Задача 9. Скільки розчину солі з масовою часткою 18% необхідно додати до 46г води, щоб утворився 15% розчин. Розв’язок:
Для приготування 15% розчину з w = 18% необхідно взяти 230г 18%–ного розчину і 46г води.
Задача 10. На нейтралізацію 25 мл розчину H2SO4 витрачено 22,5 мл 0,152 н розчину NаОН Обчислити нормальність і титр розчину кислоти. Розв’язання: Згідно з законом еквівалентів:
Відповідь: нормальність 0,1368 моль/л; титр 0,0067 г/мл.
Задача 11. Розрахувати Росм. розчину хлориду натрію з масовою часткою 5,85% при 0°С. Ступінь дисоціації хлориду натрію 0,96, а r = 1,04г/мл. Розв’язок: Переведемо масову частку в молярну концентрацію.
Розрахуємо ізотонічний коефіцієнт: і = 1 + a(n – 1) = 1 + 0,96(2 – 1) = 1,96 Осмотичний тиск розраховуємо за формулою для електролітів: Росм. = iCRT = 1,96
Задача 12. Розрахувати Росм. розчину глюкози з масовою часткою 5%, якщо t=27ОС, r=1г/мл. Розв’язок: Переведемо масову частку в молярну концентрацію.
осмотичний тиск обчислюємо за формулою неелектролітів: Росм. = C R T Pосм. = 0,28 * 0,082 * (273+27) = 6,8атм
Задача 13. Розрахувати осмотичну концентрацію крові. Або: Розрахувати молярну концентрацію водного розчину глюкози, який є ізотонічним крові. Розв’язок: Задача 14. Константа дисоціації бромнуватистої кислоти (НВrО) дорівнює 2,І Розв’язок: З закону розведення Оствальда:
Задача 15. Добуток розчинності хромату срібла Ag2CrO4 дорівнює 1,1·10–12. Обчисліть розчинність цієї солі в моль/л та г/л. Розв’язання: Записують рівняння електролітичної дисоціації хромату срібла: Ag2CrO4 D 2Ag+ + CrO та вираз його добутку розчинності:
Позначають розчинність Ag2CrO4 через S моль/л хромат–іонів та 2S моль/л катіонів срібла. Ці значення концентрації іонів підставляють у вираз добутку розчинності Ag2CrO4:
Обчислюють розчинність солі в моль/л:
Оскільки рівноважна концентрація хромат–іонів у розчині чисельно дорівнює розчинності хромату срібла, то розчинність Ag2CrO4 дорівнює 6,5·10–5 моль/л. Перемножуючи розчинність солі на її молярну масу, обчислюють розчинність хромату срібла в г/л: (Ag2CrO4) = 6,5·10–5·331,8 = 2,2·10–2г/л.
— в розчинах сильних електролітів: — кислот: pH = –lg[H+] = –lgСн(к–ти) = –lgZ·Cм(к–ти) Сн(к–ти) = antilg pH = 10–pH; См = — лугів: рОН = –lg[OH–] = –lgCн(лугу) = –lgZ·Cм(лугу) рН = 14 – рОН Сн(лугу) = antilg pOH = 10–pOH; См = — в розчинах слабких електролітів: — кислот: (дисоціація переважно іде по І ступеню) pH = –lg[H+] = –lga·См(к–ти) = –lg Cм(к–ти) = — основ: (дисоціація іде по І ступеню) рОН = –lg[OH–] = –lga·См(основи) = –lg Cм(основи) =
Задача 16. Обчислити рН розчину з концентрацією іонів водню 4,2·10–5моль/л. Розв’язання: [H+] = 4,2·10–5; рН = –lg[H+] = –lg4,2·10–5 = 5–lg4,2 = 4,38
Задача 17. Обчислити рН розчину соляної кислоти з Сн = 0,15 моль/л і розчину гідроксиду натрію з Сн = 0,2 моль/л, a = 1. Розв’язання: 1) рН = –lg[H+]; [H+] = a·Ск–ти = 1·0,15 = 0,15моль/л; рН = –lg1,5·10–1 = 1–lg1,5 = 0,824 2) рН + рОН = 14; рН = 14–рОН; [OH–] = a·Cосн. = 1·0,2 = 0,2моль/л; рОН = –lg[ОH–] = = –lg0,2 = 0,7; рН = 14–0,7 = 13,3.
Задача 18. Обчислити рН розчину мурашиної кислоти з Сн = 0,1 моль/л, Кg = 1,8·10–4. Розв’язання: рН = –lg[H+]; [H+] = a·C; Кg = a2·C; a= pH = –lg
Задача 19. Як зміниться рН води, якщо 80 мл її долити до 20 мл розчину гідроксиду натрію з Сн = 0,1 моль/л, a = 1. Розв’язання: рН(води) = 7. Після розведення V2 = 80 + 20 = 100мл V1·C1 = V2·C2; C2 = [OH–] = a·C = 1·0,2 = 2·10–2, pOH = –lg2·10–2 = 1,7; pH = 14 – 1,7 = 12,3; DpH = 12,3 – 7 = 5,30.
Задача 20. Обчислити [Н+] крові, якщо рН = 7,36. Розв’язання: Знаходять антилогарифм числа 7,36; [Н+] = 4,4·10–8моль/л.
Розрахунки рН в розчинах солей. — сіль утворена сильною кислотою та слабкою основою (NH4Cl, Fe(NO3)3)
— сіль утворена сильною основою та слабкою кислотою (K2CO3, Na3PO4)
pH = 14 – pOH Задача 21. Обчисліть рН 0,5Н розчину карбонату натрію, якщо Розв’язання: Карбонат натрію — це сіль, утворена слабкою двоосновною кислотою, тому на першій стадії гідролізу утворюється кисла сіль та сильна основа. Подальшому перебігу гідролізу перешкоджає накопичення в розчині гідроксид–іонів. Записують іонні та молекулярні рівняння реакції гідролізу: CO32– + H2O D HCO3– + OH– Na2CO3 + H2O D NaHCO3 + NaOH Cм =
рН = 14 – 2,14 = 11,86
Задача 22. Обчислити рН буферної системи, яка складається із 100мл розчину оцтової кислоти з С = 0,1моль/л і 200мл розчину ацетату натрію з С = 0,2моль/л, Кд = 1,75 Розв’язання: рН = –lg Кд + lg
Задача 23. Обчислити об’єм розчину ацетату натрію з С = 0,1моль/л і об’єм оцтової кислоти з C = 0,1моль/л, які необхідно змішати, щоб приготувати 3л ацетатного буферу з рН = 5,24 (Кд = 1,75·10–5). Розв’язання: рН = –lg Кд+lg lg Антилогарифм числа 0,48 дорівнює 3. [V(солі)] / [V(кислоти)] = 3/1. Отже, потрібно 3 частини розчину солі і одну частину розчину кислоти для приготування буферної системи з рН = 5,24. Об’єм розчину солі дорівнює: 3000·3/4 = 2250мл, а кислоти 3000·1/4 = 750мл.
|




 1 Ст. окисл. = +3 Ст. окисл. = +5
1 Ст. окисл. = +3 Ст. окисл. = +5

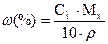


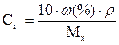





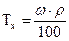


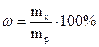


 , звідки: mx = CМ·Mx·Vp = 2·58,5·1 = 117г
, звідки: mx = CМ·Mx·Vp = 2·58,5·1 = 117г звідки: mx = Cн·Mx·fекв.х·Vp = 0,5·158·
звідки: mx = Cн·Mx·fекв.х·Vp = 0,5·158·  = 31,6г.
= 31,6г. ; звідки:
; звідки:  моль/кг.
моль/кг. звідки:
звідки:  г/мл.
г/мл. (моль/л).
(моль/л).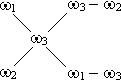

 г,
г, г
г (мл)
(мл) мл
мл 0,15
0,15
 ;
;  ;
;  моль/л
моль/л
 г/моль
г/моль г/мл
г/мл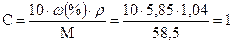 моль/л
моль/л моль/л.
моль/л. моль/л
моль/л ; тоді
; тоді  ; a = 4,58·10-4, або a = 0,046%.
; a = 4,58·10-4, або a = 0,046%.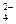


 моль/л.
моль/л. .
.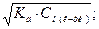
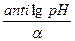 =
= 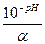 ; Сн = Z·Cм
; Сн = Z·Cм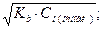
 ; Сн = Z·Cм
; Сн = Z·Cм ; [H+] =
; [H+] =  ;
; = –lg
= –lg  = –lg4,24·10–3 = 2,37.
= –lg4,24·10–3 = 2,37. =
=  = 0,02; pOH = –lg[OH–];
= 0,02; pOH = –lg[OH–]; ;
;
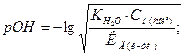
 = 4,5·10–7,
= 4,5·10–7,  = 4,7·10–11.
= 4,7·10–11. моль/л
моль/л =
= 
 = –lg1,75·10–5+lg
= –lg1,75·10–5+lg  = 5,36.
= 5,36. = lg1,75·10–5+lg
= lg1,75·10–5+lg  ;
;


