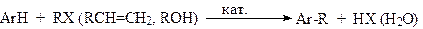С-алкилирование аренов
Таблица вычислений. Материальный 6аланс.
Конверсия бензола: α = (88,7400-52,3728)/88,7400 = 0,4098;
Селективность по МАБ: β = 28,7390/(88,7400-52,3728)=0,7903;
Выход МАБ: γ = 28,7390/88,7400=0,3239;
При данных условиях процесса выход и селективность МАБ составили 32,39% и 79,03% соответственно, конверсия бензола 40,98%. Вывод: с увеличением времени проведения реакции возрастает выход целевого продукта.
Процессы алкилирования Алкилирование - процесс замещения атома водорода или металла в молекуле субстрата на алкил. Различают С-, N- и О-алкилирование. Если в молекулу вводится арил, реакция называется арилированием. В качестве алкилирующих агентов используют главным образом, галогенпроизводные, непредельные соединения, спирты и эфиры серной и сульфокислот. Алкилирование используется для построения углеродного скелета молекулы, а также защиты функциональных групп (гидроксильной или аминогруппы). С-алкилирование аренов С-Алкилирование аренов можно проводить по Вюрцу-Фиттигу, Вюрцу-Гриньяру и т.д., но в промышленности чаще всего используется реакция Фриделя –Крафтса:
В качестве алкилирующих агентов применяют в основном алкилгалогениды, алкены и спирты. 1.Механизм реакции - обратимое электрофильное замещение (SE). Скорость реакции определяется устойчивостью s-комплекса а также концентрацией реагирующих веществ и катализатором. Направление реакции в связи с её обратимостью зависит от условий её проведения: 1) в мягких условиях определяется устойчивостью s-комплекса (кинетический контроль) и выполняются правила ориентации. 2) в жестких условиях (значительные температура, длительность процесса, количества катализатора) - определяется устойчивостью конечных продуктов (термодинамический контроль реакции) и правила ориентации не выполняются. Например, при метилировании толуола метилхлоридом при 0°С образуется 27% м -ксилола, при 55° - 87%, а при 106°С – 98%.
2. Основные недостатки реакции Фриделя-Крафтса: 1) Полиалкилирование,что объясняется большей реакционной способностью продуктов алкилирования, чем исходного субстрата.
2) Изомеризация радикала, которая вызвана превращением образующегося карбкатиона в более стабильный. Например:
3) Изомеризация продукта реакции, которая вызвана обратимостью реакции. Например: При нагревании п -ксилола с хлористым водородом и AlCl3, большая часть углеводорода превращается в термодинамически более устойчивый м -ксилол:
При этом в ряде случаев добавление веществ, связывающих галогеноводород, предотвращает обратимость реакции. 4) Диспропорционирование алкиларенов. Одновременно может происходить и изомеризация перемещающейся группы:
Изомеризация и диспропорционирование конечного продукта в кислой среде может служить доказательством обратимости процесса алкилирования. 3. Катализаторы в процессах алкилирования: 1. Протонные кислоты - их активность как катализаторов не зависит от Кдис. и падает в ряду HF > H2SO4 > H3PO4. 2. Апротонные кислоты (кислоты Льюиса) - по активности их можно расположить в следующий ряд: AlBr3 > AlCl3 > FeCl3 > ZnCl2 3. Оксиды металлов и бора ( B2O3 ). Наиболее активными оказались амфотерные оксиды ( Al2O3, Cr2O3 и др. ), модифицированные BF3. 4. Цеолиты, общей формулы M2/nО.Al2O3.xSiO2.yH2O, где М – металл; n – его валентность. 5. Катиониты,представляющие собой полимеры (чаще всего полистирольные), содержащие –SO3H, -COOH, -PO3H2 и другие группы. Активность катализатора зависит также и от 1) строения субстрата; 2) природы алкилирующего агента; 3) условий реакции (температура, давление и т.д.). Например, BF3 является активным катализатором при алкилировании спиртами, алкенами, фторпроизводными, но при алкилировании другими алкилгалогенидами его активность мала.
|