
Головна сторінка Випадкова сторінка
КАТЕГОРІЇ:
АвтомобіліБіологіяБудівництвоВідпочинок і туризмГеографіяДім і садЕкологіяЕкономікаЕлектронікаІноземні мовиІнформатикаІншеІсторіяКультураЛітератураМатематикаМедицинаМеталлургіяМеханікаОсвітаОхорона праціПедагогікаПолітикаПравоПсихологіяРелігіяСоціологіяСпортФізикаФілософіяФінансиХімія
ЗМАГАННЯ
Дата добавления: 2015-08-29; просмотров: 861
|
|
Химические реакции с дисперсным катализатором чаще всего осуществляют в неподвижном слое частиц катализатора, через который фильтруются газовая или жидкая фаза.
Катализаторы обычно представляют собой мелкопористые дисперсные частицы, внутри на наружной поверхности которых происходит каталитическая реакция реагентов, непрерывно поступающих в слой со сплошным потоком. Температурные режимы работы как отдельных зерен катализатора, так и всего слоя частиц очень существенны, поскольку скорость реагирования исходных компонентов экспоненциально зависит от температуры, а перегрев катализатора может привести к появлению нежелательных побочных реакций или потере каталитической активности.
Анализ работы каталитических реакторов состоит в совместном рассмотрении процессов тепло- и массопереноса и кинетики химических реакций.
Особенность каталитических превращений заключается в сравнительно малой изученности многочисленных стадий промежуточных реакций. Принято рассматривать следующие последовательные стадии процесса на одном зерне:
1) подвод реагентов к наружной поверхности зерна из основной массы потока;
2) диффузия реагентов внутри зерна по его пористой структуре;
3) адсорбция молекул реагентов на поверхности пор;
4) собственно каталитическая реакция, происходящая на внутренней поверхности пор;
5) десорбция продуктов реакции;
6) диффузия продуктов реакции из внутренних участков зерна к его наружной поверхности;
7) отвод продуктов реакции от наружной поверхности зерна катализатора в поток сплошной среды.
Все перечисленные стадии оказывают в разной степени влияние на общую скорость химической реакции.
Различают следующие области протекания гетерогенных реакций в зависимости от характера преобладающего сопротивления:
1) внутридиффузионная, когда общая скорость химической реакции определяется скоростью диффузионного переноса реагентов внутрь зерна по поровым каналам;
2) внутрикинетическая, соответствующая низким температурам, когда самой медленной стадией является собственно химическая реакция;
3) внешнедиффузионная означает, что лимитирующей стадией является подвод реагентов из основного потока к наружной поверхности зерна катализатора, что имеет место при высоких температурах и мелких зернах;
4) внешнекинетическая соответствует реакции, происходящей на наружной поверхности зерна, когда внутреннее диффузионное сопротивление столь велико, что реагенты практически не попадают во внутренние поры.
Чаще всего реализуются внутридиффузионная и внутрикинетическая области протекания каталитических реакций. По мере увеличения температуры реакция из внутрикинетической области переходит во внутридиффузионную, поскольку скорость реакции, вначале лимитирующая общий процесс, быстро возрастает. Таким образом, по мере изменения температуры влияние отдельных стадий изменяется, поэтому теплообменные процессы, от которых зависит температура в зоне реакции, очень существенны при анализе работы химических реакторов.
Рассматривается тепловой баланс для химической реакции, происходящей на некоторой поверхности катализатора. Для стационарного температурного режима поверхности количество конвективно отводимой от поверхности теплоты равно количеству теплоты, выделяющейся в результате реакции:
a( Тп – Т¥) = r (Сп, Тп) h, (3.68)
где r (Сп, Тп) – скорость химической реакции, зависящая от концентрации реагента Сп, лимитирующего реакцию, на поверхности и от температуры поверхности Тп; h – удельная теплота химической реакции, отнесенная к единице поверхности; Т¥ – температура реагентов вдали от поверхности.
Материальный баланс по компоненту, концентрация которого лимитирует химическую реакцию:
b(С¥ - Сп) = r (Сп, Тп), (3.69)
где b – коэффициент массоотдачи; С¥ – концентрация реагента в основной массе потока.
Из этих уравнений
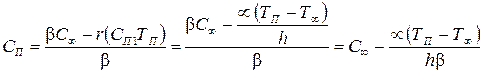 (3.70)
(3.70)
и уравнение теплового баланса
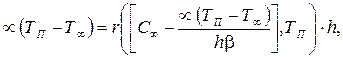 (3.71)
(3.71)
где скорость реакции r выражена через температуру реакционной поверхности Тп .
Уравнение (3.71) решается относительно неизвестной температуры Тп, что дает возможность найти Сп и определить установившуюся на поверхности скорость реакции r(Сп, Тп). Явный вид зависимости r(Сп, Тп) для конкретной реакции должен быть известен (рис. 3.18).
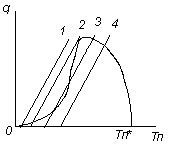 Уравнение (3.71) может быть приближенно решено наглядным графическим методом (рис. 3.18). Прямым параллельным линиям соответствует левая часть уравнения с различными значениями температуры Т¥. А линией, имеющей экстремум и перегиб, изображена типичная зависимость скорости химической реакции от температуры. При Тп* концентрация основного компонента в зоне реакции станет равной 0, что соответствует пересечению кривой скорости реакции с осью абсцисс. Значение Тп* определится из уравнения для Сп при Сп = 0.
Уравнение (3.71) может быть приближенно решено наглядным графическим методом (рис. 3.18). Прямым параллельным линиям соответствует левая часть уравнения с различными значениями температуры Т¥. А линией, имеющей экстремум и перегиб, изображена типичная зависимость скорости химической реакции от температуры. При Тп* концентрация основного компонента в зоне реакции станет равной 0, что соответствует пересечению кривой скорости реакции с осью абсцисс. Значение Тп* определится из уравнения для Сп при Сп = 0.
 Наличие перегиба на левой ветви кривой скорости реакции приводит к существованию как устойчивых, так и неустойчивых температурных режимов реакции. При увеличении температуры исходной реакционной смеси Т¥ прямая теплоотвода будет перемещаться параллельно вправо. Точка пересечения первой линии соответствует низким температурам Тп, т.е. малой скорости реакции, протекающей в кинетической области. В положении 2 появляется возможность перехода реакции в область высоких значений температуры. Дальнейшее увеличение температуры Т¥ (положение 3) соответствует трем возможным температурным уровням и трем скоростям реакции. Средний температурный режим оказывается неустойчивым, поскольку любое случайное увеличение температуры Тп приводит к превышению тепловыделения над теплоотводом, а уменьшение Тп, наоборот, приведет к превышению теплоотвода над тепловыделением и охлаждению реакционной поверхности до нижнего температурного уровня. Устойчивым оказывается режим с одной точкой пересечения правее положения 4, соответствующей устойчивой реакции в области высоких температур и высоких скоростей реакции, лимитируемых диффузией реагентов к зоне реагирования.
Наличие перегиба на левой ветви кривой скорости реакции приводит к существованию как устойчивых, так и неустойчивых температурных режимов реакции. При увеличении температуры исходной реакционной смеси Т¥ прямая теплоотвода будет перемещаться параллельно вправо. Точка пересечения первой линии соответствует низким температурам Тп, т.е. малой скорости реакции, протекающей в кинетической области. В положении 2 появляется возможность перехода реакции в область высоких значений температуры. Дальнейшее увеличение температуры Т¥ (положение 3) соответствует трем возможным температурным уровням и трем скоростям реакции. Средний температурный режим оказывается неустойчивым, поскольку любое случайное увеличение температуры Тп приводит к превышению тепловыделения над теплоотводом, а уменьшение Тп, наоборот, приведет к превышению теплоотвода над тепловыделением и охлаждению реакционной поверхности до нижнего температурного уровня. Устойчивым оказывается режим с одной точкой пересечения правее положения 4, соответствующей устойчивой реакции в области высоких температур и высоких скоростей реакции, лимитируемых диффузией реагентов к зоне реагирования.
| <== предыдущая лекция | | | следующая лекция ==> |
| Виконання військового вітання у складі взводу | | | СТРОЙОВИЙ ОГЛЯД РОТИ |