Общее число степеней свободы
где
iкп - число степеней свободы колебаний точки при поступательном движении; iквр - число степеней свободы колебаний точки при вращательном движении. Молекулы газа имеют число степеней свободы: а) одноатомная - i = 3 (три степени свободы поступательного движения); б) двухатомная при упругой связи между атомами - i = 6; в) двухатомная при жёсткой связи между атомами - i = 5; г) трёхатомная молекула при жёсткой связи между атомами - i = 6. Теорема о равномерном распределении энергии по степеням свободы: на любую степень свободы приходится в среднем одинаковая энергия, равная
где i = iп + iвр + iк. Внутренняя энергия произвольной массы газа m складывается из энергии отдельных молекул:
где m - молярная масса газа. Теплоемкость - физическая величина, численно равная количеству теплоты, которое необходимо сообщить веществу для нагревания его на один градус. Удельная теплоёмкость " c" - физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус. Молярная теплоёмкость " C" - физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус:
Удельная теплоёмкость при постоянном объеме" cv" - физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного объема:
Удельная теплоёмкость при постоянном давлении " cp" - физическая величина, численно равная количеству теплоты, которое необходимо сообщить единице массы вещества для нагревания её на один градус в условиях постоянного давления:
Молярная теплоёмкость при постоянном объеме " Cv" - физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного объема:
Молярная теплоёмкость при постоянном давлении " Cp" - физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю вещества, чтобы увеличить его температуру на один градус в условиях постоянного давления:
Отношение молярных и удельных теплоемкостей g:
Средняя квадратичная скорость молекул ( для газа массой " m", находящегося в состоянии равновесия, при T = const) остаётся постоянной:
где Ni - число молекул, обладающих скоростью vi; N - число всех молекул. Наиболее вероятная скорость - скорость движения молекул, которая характеризует положение максимума функции распределения Максвелла:
|

 (2.8)
(2.8) - число степеней свободы поступательного движения;
- число степеней свободы поступательного движения; - число степеней свободы вращательного движения;
- число степеней свободы вращательного движения; - число степеней свободы колебательного движения;
- число степеней свободы колебательного движения;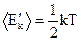 , а молекула, обладающая i степенями свободы, обладает энергией
, а молекула, обладающая i степенями свободы, обладает энергией (2.9)
(2.9) , (2.10)
, (2.10) . (2.11)
. (2.11) (2.12)
(2.12) . (2.13)
. (2.13) .
. 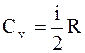 . (2.14)
. (2.14) ,
,  . (2.15)
. (2.15) (2.16)
(2.16) или
или  , (2.17)
, (2.17)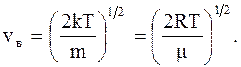 (2.18)
(2.18)


