Изменение энтропии системы при переходе из одного состояния в другое
Изменение энтропии системы при переходе из одного состояния в другое:
Изменение энтропии системы при изотермическом процессе:
Изменение энтропии системы при изобарическом процессе:
Изменение энтропии системы при изохорическом процессе:
Изменение энтропии системы при адиабатическом процессе: DS = 0, Изменение энтропии системы, совершающей цикл Карно:
где DSр - изменение энтропии рабочего тела; DSн, DSх - изменение энтропии нагревателя и холодильника; DSпр - изменение энтропии " потребителя работы". В случае совершения системой обратимого цикла Карно энтропия замкнутой системы не изменяется: DSобр = 0 или Sобр=const. (2.55) В случае совершения системой необратимого цикла Карно энтропия замкнутой системы возрастает: DS > 0; Для произвольных процессов, происходящих в замкнутой системе, энтропия системы для любых происходящих в ней процессов не может убывать: DS ³ 0 или где знак равенства справедлив для обратимых процессов, а знак неравенства - для необратимых. Второе начало термодинамики: в изолированной системе возможны только такие процессы, при которых энтропия системы возрастает или невозможен процесс, единственным результатом которого является превращение в работу теплоты, полученной от нагревателя:
Термодинамические потенциалы - определенные функции объема V, давления p, температуры T, энтропии S, числа частиц системы N и других макроскопических параметров x, характеризующих состояние термодинамической системы: а) внутренняя энергия - энергия системы, зависящая от ее внутреннего состояния. Она является однозначной функцией независимых переменных, определяющих это состояние, например температуры T и объема V (или давления p): U = U(S, V, N, x). (2.59) Изменение внутренней энергии системы DU определяется лишь ее значениями в начальном и конечном состояниях:
б) энтальпия (теплосодержание) характеризует состояние макроскопической системы в термодинамическом равновесии при выборе в качестве основных независимых переменных энтропии S и давления p: H = H(S, p, N, x). (2.61) Энтальпия системы равна сумме энтальпий составляющих ее частей. Связь энтальпии с внутренней энергией U системы:
где V - объем системы.
|

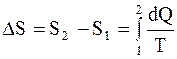 . (2.48)
. (2.48) . (2.49)
. (2.49)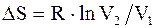 . (2.50)
. (2.50) . (2.51)
. (2.51) . (2.52)
. (2.52) . (2.53)
. (2.53)
 , (2.54)
, (2.54) ;
;  . (2.56)
. (2.56) , (2.57)
, (2.57) . (2.58)
. (2.58) . (2.60)
. (2.60) , (2.62)
, (2.62)


