Кинетическая энергия тела
Полная энергия тела складывается из внутренней энергии и кинетической энергии тела как целого:
где Энергия связи системы каких-либо частиц - работа, затраченная на разделение системы на составляющие ее частицы и удаление их друг от друга на такое расстояние, на котором их взаимодействием можно пренебречь:
где Eсв - энергия связи; å Ei - сумма энергий разделенных частиц системы; E - энергия системы. Сумма масс разделенных частиц больше массы системы на величину энергии связи, деленную на c2:
Дефект массы Dm - разность между суммой масс частиц и массой системы:
Закон взаимосвязи массы и энергии:
Закон изменения импульса-энергии материальной точки:
Закон изменения энергии материальной точки:
Закон изменения кинетической энергии тела:
Соотношение, связывающее полную энергию и импульс релятивистской частицы (в векторной форме):
Связь между импульсом и полной энергией в скалярной форме:
Связь между импульсом и кинетической энергией:
Для частиц с нулевой массой покоя энергия пропорциональна импульсу: E = c× p; p = E/c. (1.218) Кинетическая масса частиц, которые не обладают массой покоя, равна полной массе:
2. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ 2.1. Основные понятия молекулярной физики и термодинамики Молекулярная физика - раздел физики, в котором изучаются физические свойства и строение вещества в различных агрегатных состояниях на основе их микроскопического (молекулярного) строения. Молекулярно-кинетическая теория строения вещества - раздел молекулярной физики, в котором изучаются свойства тел на основе представлений об их молекулярном строении. Статистическая физика – раздел молекулярной физики, в котором изучаются свойства и движения не отдельных молекул (частиц), а совокупности частиц, характеризующиеся средними величинами. Термодинамика – наука, в которой изучаются свойства физических систем вне связи с их микроскопическим строением. Система – совокупность рассматриваемых тел (в частности: молекул, атомов, частиц). Параметры состояния системы: p-давление, V- объём, T-температура. а) Интенсивные параметры - параметры (давление, температура, концентрация и др.), не зависящие от массы системы. Температура - физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. Свойство температуры - определять направление теплового обмена. Температура в молекулярной физике определяет распределение частиц по уровням энергии и распределение частиц по скоростям. Термодинамическая температурная шкала - температурная шкала, определяемая температура (абсолютная температура) в которой всегда положительна. б) Экстенсивные параметры - параметры (объем, внутренняя энергия, энтропия и др.), значения которых пропорциональны массе термодинамической системы или ее объему. Внутренняя энергия системы - суммарная кинетическая энергия хаотического движения молекул, потенциальная энергия их взаимодействия и внутримолекулярная энергия, т.е. энергия системы без учёта кинетической энергии её в целом (при движении) и потенциальной энергии во внешнем поле. Изменение внутренней энергии при переходе системы из состояния в состояние равно разности значений внутренней энергии в этих состояниях и не зависит от пути перехода системы из одного состояния в другое. Уравнение состояния системы: F(p, V, T) = 0. (2.1) Неравновесное состояние системы – такое, при котором какой-либо из ее параметров состояния системы изменяется. Равновесное состояние системы - такое, при котором все параметры состояния системы имеют определённые значения, постоянные при неизменных внешних условиях. Время релаксации - время, в течение которого система приходит в равновесное состояние. Процесс – переход системы из одного состояния в другое состояние, связанный с изменением хотя бы одного из ее параметров состояния: а) обратимый процесс - процесс, при котором возможно осуществить обратный переход системы из конечного в начальное состояние через те же промежуточные состояния так, чтобы не осталось никаких изменений в окружающей систему среде; б) необратимый процесс - процесс, при котором невозможно осуществить обратный переход системы в первоначальное состояние, или если по окончании процесса в окружающей среде или в самой системе произошли какие-либо изменения; в) круговой процесс (цикл) - такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь. Любой круговой процесс состоит из процессов расширения и сжатия. Процесс расширения сопровождается работой, совершаемой системой, а процесс сжатия - работой, совершаемой над системой внешними силами. Разность этих работ равна работе данного цикла. Динамические закономерности - закономерности, подчиняющиеся системам уравнений (в том числе дифференциальных, интегральных и др.), допускающих существование единственного решения для каждого начального условия. Статистические закономерности - количественные закономерности, устанавливаемые статистическим методом, в котором рассматриваются лишь средние значения величин, характеризующих данную совокупность молекул (рассматривается конкретная молекулярная модель, и к ней применяются математические методы статистики, основанные на теории вероятностей). Вероятность термодинамическая - число способов, которыми может быть реализовано данное состояние макроскопической физической системы (предел, к которому стремится относительная частота появления некоторого события при достаточно большом, стремящемся к бесконечности числе повторений опыта при неизменных внешних условиях): w = n/N, (2.2) где N - число опытов; n - число раз получено определенное событие. Флуктуации - случайные отклонения физических величин от их среднего значения. Молекула - наименьшая часть вещества, обладающая его основными химическими свойствами и состоящая из атомов, соединенных между собой химическими связями. Атом - часть вещества микроскопических размеров (микрочастица), наименьшая частица химического элемента, обладающая его свойствами. Атомы в разных сочетаниях входят в состав молекул разных веществ. Относительная атомная масса - отношение массы данного атома к 1/12 массы изотопа углерода с массовым числом 12 (12С). Относительная молекулярная масса - отношение массы данной молекулы к 1/12 массы атома 12С. Моль - количество вещества, в котором содержится число частиц (атомов, молекул и других частиц), равное числу атомов в 0, 012 кг изотопа углерода С12. Число Авогадро - число атомов или молекул в моле любого вещества: NА = 6, 02× 1023 моль-1. Молярная масса - масса вещества, взятого в количестве одного моля: m = m0× NА. (2.3)
2.2. Основные представления и законы молекулярно-кинетической теории Идеальный газ - теоретическая модель газа, в которой не учитывается взаимодействие его частиц (средняя кинетическая энергия частиц много больше энергии их взаимодействия). Размеры молекул идеального газа малы по сравнению с расстояниями между ними. Суммарный собственный объем молекул такого газа мал по сравнению с объемом сосуда. Силы взаимодействия между молекулами настолько малы, что движение молекул от столкновения до столкновения происходит по прямолинейным отрезкам. Число ежесекундных столкновений молекул велико. Основные положения молекулярно-кинетической теории идеального газа: 1) газ состоит из мельчайших частиц - атомов или молекул, находящихся в непрерывном движении; 2) в любом, даже очень малом объёме, к которому применимы выводы молекулярно-кинетической теории, число молекул очень велико; 3) размеры молекул малы по сравнению с расстояниями между ними; 4) молекулы газа свободно движутся между двумя последовательными взаимодействиями друг с другом или со стенками сосуда, в котором он находится. Силы взаимодействия между молекулами, кроме моментов соударения, пренебрежимо малы. Соударения молекул происходят без потерь механической энергии, т.е. по закону абсолютно упругого взаимодействия; 5) при отсутствии внешних сил молекулы газа распределяются равномерно по всему объёму; 6) направления и значения скоростей молекул газа самые различные. Основное уравнение молекулярно-кинетической теории газов:
где Основное уравнение молекулярно-кинетической теории газов для давления:
где n0 = N'/V - число молекул в единице объема;
k - постоянная Больцмана. Закон Авогадро: в одинаковых объемах при одинаковых температурах и давлениях содержатся одинаковые количества молекул. Закон Дальтона: давление смеси газов равно сумме парциальных давлений, т.е. тех давлений, которые имел бы каждый из входящих в смесь газов, если бы в объеме, занятом смесью, находился он один:
Уравнение состояния идеальных газов для произвольной массы m (уравнение Менделева-Клапейрона):
где R - газовая постоянная, которая численно равна работе расширения одного моля газа при его нагревании на один градус в условиях постоянного давления; T - абсолютная температура. Степени свободы i - число независимых координат, необходимых для полного описания положения системы в пространстве. Все степени свободы равноправны.
|

 . (1.206)
. (1.206) , (1.205)
, (1.205) - релятивистская масса.
- релятивистская масса. , (1.208)
, (1.208) . (1.209)
. (1.209) . (1.210)
. (1.210) , E = mc2. (1.211
, E = mc2. (1.211 . (1.212)
. (1.212) =
=  . (1.213)
. (1.213) . (1.214)
. (1.214) . (1.215)
. (1.215) . (1.216)
. (1.216) . (1.217)
. (1.217) . (1.219)
. (1.219) , (2.4)
, (2.4)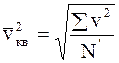 - средняя квадратичная скорость.
- средняя квадратичная скорость. ,
,  , (2.5)
, (2.5) - средняя кинетическая энергия поступательного движения молекул газа;
- средняя кинетическая энергия поступательного движения молекул газа; . (2.6)
. (2.6) , (2.7)
, (2.7)


