Пример 2. Концентрационный гальванический элемент
Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации. 1. Схема гальванического элемента. Ni / NiSO4 (
2. Вычисление электродных потенциалов по уравнению Нернста.
3. Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как
(а) Ni1 / NiSO4 (10-4 M)// NiSO4 (1 M)/ Ni2 (к)
4. Уравнения электродных полуреакций. Ni1 (–): Ni – 2ē = Ni2+ - процесс окисления; Ni2 (+): Ni2+ + 2ē = Ni - процесс восстановления. 5. Расчет величины ЭДС. ЭДС =
Пример 3. Гальванический элемент на основе окислительно-восстановительной реакции с инертным (С) электродом: K2Cr2O7 + Zn + H2SO4 = Cr2(SO4)3 + 3 ZnSO4 + K2SO4 + 7 H2O Ох Red 1. Схема гальванического элемента – Zn / Zn2+ (1М) // 2. Используем значения стандартных электродных потенциалов, так как концентрации ионов в растворе равны 1 моль/л.
3. Направление движения электронов – от цинкового электрода к угольному, так как
– Zn / Zn2+ // 4. Уравнения электродных процессов. Zn (–): Zn – 2ē = Zn2+ - процесс окисления С (+): 5. Суммарные уравнения. 3 Zn + 3 Zn + K2Cr2O7 + 7 H2SO4 = 3 ZnSO4 + Cr2(SO4)3 + 7 H2O + K2SO4 6. Расчет величины ЭДС. ЭДС = Е0Ох – Е0Red = 1, 36 – (–0, 76) = 2, 12 В.
|

 = 10–4 моль/л) // NiSO4 (
= 10–4 моль/л) // NiSO4 ( = – 0, 25 В.
= – 0, 25 В. =
=  +
+ 
 = – 0, 25 +
= – 0, 25 +  =
=  .
. ē
ē
 (-) (+)
(-) (+)



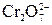 , Cr3+ (1М) / С +
, Cr3+ (1М) / С + = – 0, 76 В;
= – 0, 76 В;  = 1, 36 В.
= 1, 36 В.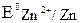 .
.

 ē
ē


