Составление уравнений окислительно-восстановительных реакций
Для нахождения коэффициентов при составлении окислительно-восстановительных реакций необходимо: - соблюдение материального баланса (число атомов данного элемента в левой и правой части должно быть одинаково); - соблюдение электронного баланса: число электронов, отданных восстановителем (Red), должно быть равно числу электронов, принятых окислителем (Ох). Например: Al + Cl2 → AlCl3 Red Ох
3 Cl2 + 2 ē = 2 Cl– процесс восстановления, или полуреакция
2 Al +3 Cl2 = 2 Al3+ + 6 Cl– 2 Al +3 Cl2 = 2 AlCl3 При составлении уравнений окислительно-восстановительных реакций в водных растворах часто возникает необходимость использовать среду (Н+, ОН–, Н2О). При этом, если частица в левой части полуреакции содержит кислорода больше, чем в правой (
|

 2 Al – 3 ē = Al3+ процесс окисления, или полуреакция окисления
2 Al – 3 ē = Al3+ процесс окисления, или полуреакция окисления восстановления
восстановления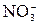 →
→  ), то нужно связать «О2–», если частица в левой части полуреакции содержит кислорода меньше, чем в правой части (
), то нужно связать «О2–», если частица в левой части полуреакции содержит кислорода меньше, чем в правой части (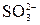 →
→  ), то нужно ввести «О2–».
), то нужно ввести «О2–».


