ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. Окислительно-восстановительныминазывают реакции, протекающие с изменением степени окисления элементов
Окислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов. Степень окисления – это условный заряд атома элемента, который вычисляют, исходя из предположения, что молекула состоит только из ионов (как правило, обозначается арабской цифрой, заряд ставят перед цифрой). Для нахождения степени окисления используют следующие правила: - степень окисления атомов в простых веществах равна нулю. - фтор во всех соединениях без исключения имеет степень окисления -1. - степень окисления кислорода равна -2 (исключение: фториды кислорода, например OF2; пероксиды, субоксиды, озониды). - степень окисления водорода равна +1 (исключение – гидриды металлов, например NaH, CaH2 и др.). - степень окисления щелочных металлов в соединениях равна +1, щелочноземельных +2, алюминия +3. - алгебраическая сумма степеней окисления в молекуле равна нулю. Для определения степени окисления атомов элементов составляют простейшие алгебраические уравнения. Например, для MnO2, K2MnO4, KMnO4 степень окисления марганца (х): MnO2 х + 4 · (-2) = 0 х = +4 K2MnO4 2 · (+1) + х + 4 · (-2) = 0 х = +6 KMnO4 1 + х + 4 · (-2) = 0 х = +7 - заряд иона равен алгебраической сумме степеней окисления атомов элементов, входящих в состав иона.
Заряд иона, как правило, ставят после цифры.
|

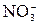 +5 + 3 · (-2) = -1
+5 + 3 · (-2) = -1 +6 + 4 · (-2) = -2
+6 + 4 · (-2) = -2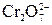 +2 · (+6) +7 · (-2) = -2
+2 · (+6) +7 · (-2) = -2


