Правила использования среды
Последовательность однотипных операций, с помощью которых составляют уравнения полуреакций с использованием среды для реакций: K2Cr2O7 + KI + H2SO4 → Cr2(SO4)3 + I2 + H2O + K2SO4 1. Записывают исходные вещества и продукты полуреакций окисления и восстановления (сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы, осадки – в виде молекул):
2. Уравнивают количество атомов элемента, изменяющего степень окисления:
3. По изменению степени окисления подсчитывают количество отданных или принятых электронов:
4. При необходимости уравнивают кислород и водород, используя правила среды:
5. Проверяют суммарный заряд ионов и электронов левой и правой части уравнения. 6. Составляют суммарное ионное уравнение реакции:
7. Составляют суммарное молекулярное уравнение реакции: K2Cr2O7 + 6 KI + 7 H2SO4 = Cr2(SO4)3 + 3 I2 + 7 H2O + 4 K2SO4
Пример 1. Среда кислая Na3PO3 + KMnO4 + H2SO4 → Na3PO4 + MnSO4 Red Ох
2
5 5 5 Na3PO3 + 2 KMnO4 + 3 H2SO4 = 5 Na3PO4 + 2 MnSO4 + 3 H2O + K2SO4
Пример 2. Среда щелочная KCrO2 + KClO4 + KOH → K2CrO4 + KCl + … Red Ох
3
8 8 8 KCrO2 + 3 KClO4 + 8 KOH = 8 K2CrO4 + 3 KCl + 4 H2O
Пример 3. Среда нейтральная KMnO4 + MnSO4 + H2O → MnO2 + … Red Ох
2
3 Mn2+ + 2 3 Mn2++ 2 3 MnSO4 + 2 KMnO4 + 2 H2O = 5 MnO2 + K2SO4 + 2 H2SO4
|

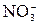 →
→ 
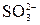 →
→ 
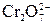 → Cr3+; I– → I2
→ Cr3+; I– → I2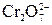 = 2 Cr3+; 2I– = I2
= 2 Cr3+; 2I– = I2 5
5  – 2ē + H2O =
– 2ē + H2O =  + 2 Н+
+ 2 Н+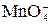 + 5ē + 8 Н+= Mn2+ + 4 H2O
+ 5ē + 8 Н+= Mn2+ + 4 H2O
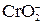 – 3ē + 4 ОН– =
– 3ē + 4 ОН– =  + 2 H2O
+ 2 H2O + 8ē + 8 H2O = Cl– + 8 ОН–
+ 8ē + 8 H2O = Cl– + 8 ОН–


