Анодные процессы
На аноде возможны процессы окисления: - материал анода Me – nē = Men+; - молекул воды 2 H2O – 4ē = О2↑ + 4Н+; - анионов солей 2 Cl– – 2ē = Cl2; Анионы кислородсодержащих кислот, имеющие в своем составе атом элемента в высшей степени окисления ( Пример 1. Электролиз водного раствора сульфата калия с инертными электродами: К2SO4 = 2 К+ +
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами: SnCl2 = Sn2+ + 2Cl–
Пример 3. Электролиз сульфата меди с медным анодом: CuSО4 = Cu2+ +
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем в 1834 г. Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока: m = M где m – масса образовавшегося вещества, г; М – молярная масса вещества, г/моль; n – количество электронов, участвующих в электродном процессе; I – сила тока, А; t – время электролиза, с; F – постоянная Фарадея (96500 Кл/моль). Для газообразных веществ, выделяющихся при электролизе, формулу используют в виде V = V0 где V – объем газа, выделяющегося на электроде; V0 – объем 1 моль газообразного вещества при нормальных условиях (22, 4 л/моль). Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4 А. Решение: mSn = 118, 7∙
|

 – 2ē + H2O →
– 2ē + H2O → 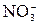 + 2Н+.
+ 2Н+. ,
, 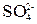 .
. = - 2, 92B,
= - 2, 92B,  ≈ - 1B,
Так как
≈ - 1B,
Так как  ≈ 1, 8 В
2Н2О – 4ē = О2 + 4Н+.
Среда кислая.
≈ 1, 8 В
2Н2О – 4ē = О2 + 4Н+.
Среда кислая.
 = - 0, 136 B,
= - 0, 136 B,
 = + 1, 36 В
= + 1, 36 В
 = + 0, 34 В;
= + 0, 34 В;  ,
,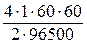 = 8, 86 г; VCl2 = 22, 4∙
= 8, 86 г; VCl2 = 22, 4∙ 


