ЖЕСТКОСТЬ ВОДЫ
Жесткость воды обуславливается наличием в ней различных соединений кальция и магния. Термин жесткость стали применять в связи с тем, что соли кальция и магния образуют с мылами нерастворимые «жесткие» соединения. По качественному составу жесткость характеризуется следующим образом. Жесткость, создаваемая катионами кальция – кальциевая жесткость (ЖCa), катионами магния – магниевая жесткость (ЖMg). Гидрокарбонатные анионы ( Снижение жесткости или умягчение воды производят физическими методами (например, термическим), реагентным, катионированием. Термический метод основан либо на испарении воды с последующей дистилляцией пара (получают дистиллированную воду), либо просто нагреванием, при котором гидрокарбонаты переходят в карбонаты, растворимые гораздо хуже: t М(НСО3)2 → МСО3 + Н2О + СО2↑ Таким образом можно удалить только Жкарб. Остаточная жесткость зависит от растворимости образующихся карбонатов. Реагентные методы основаны на переводе солей кальция и магния в труднорастворимые (осаждение) или прочные комплексные соединения. В качестве осадителей используют известь Ca(OH)2, соду Na2CO3, соли фосфорной кислоты Na3PO4. В результате обработки воды осадителями образуются труднорастворимые соединения Mg(OH)2, CaCO3, Ca3(PO4)2, Mg3(PO4)2. Остаточная жесткость после реагентного умягчения определяется произведением растворимости образующихся соединений. Метод катионирования основан на способности некоторых соединений, практически нерастворимых в воде, вступать в реакции обмена с катионами, находящимися в воде. Такие соединения называют катионитами. Воду с определенной скоростью пропускают через катионит и происходит реакция обмена, например: 2NaR + Ca2+ = CaR2 + 2Na+ 2HR + Ca2+ = CaR2 + 2H+. В результате катионы кальция из воды удаляются, заменяясь на катионы натрия или водорода. После насыщения катионита катионами кальция и магния, катиониты регенерируют. В настоящее время жесткость принято выражать в градусах жесткости. За 10 жесткости принимают содержание в воде ионов Ca2+ и Mg2+, равное0, 5·10-3 моль в литре воды. Пример 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202, 5 г Са(НСО3)2. Решение. В одном литре воды содержится 202, 5: 500 = 0, 405 г Са(НСО3)2, что составляет 0, 405: 162 = 2, 5·10-3 моль Са(НСО3)2 или 2, 5·10-3 моль. Таким образом, Ж = 2, 5·10-3 / 0, 5·10-3 = 50 Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 40? Решение. Молярная масса CaSO4 равна 136 г/моль. В 1 литре воды содержится 4·0, 5·10-3 = 2·10-3 моль CaSO4, что составляет 2·10-3·136 = 2, 72·10-1 г. В 1 м3 воды содержится 2, 72·10-1·103 = 272 г CaSO4. Пример 3. Какую массу соды Na2CO3 надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 50? Решение. Жесткость 10 соответствует 0, 5·10-3 моль ионов Mе2+ (где Ме2+ ≡ Са2+ или Mg2+). По условию задачи содержание Mе2+ в 1 литре воды составляет 5·0, 5·10-3 = 2, 5·10-3 моль. В 500 л такой воды содержится 500·2, 5·10-3 = 1, 25 моль Mе2+. Устранение жесткости заключается в связывании ионов Mе2+ ионами Mе2+ + Согласно уравнению, число моль ионов
|

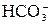 ) создают карбонатную или временную жесткость, остальные анионы – постоянную жесткость (Жпост). Сумму ЖCa и ЖMg называют общей жесткостью (Жобщ).
) создают карбонатную или временную жесткость, остальные анионы – постоянную жесткость (Жпост). Сумму ЖCa и ЖMg называют общей жесткостью (Жобщ).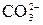 :
:


