ГИДРОЛИЗ СОЛЕЙ. Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды
Гидролиз солей – это процесс взаимодействия ионов соли с молекулами воды, приводящий к смещению ионного равновесия воды и изменению рН среды. Гидролиз является обратимым процессом. В реакциях гидролиза участвуют ионы слабых электролитов: катионы слабых оснований и анионы слабых кислот. Причина гидролиза – образование слабодиссоциированных или труднорастворимых продуктов. Следствием гидролиза является нарушение равновесия в системе H2O ↔ H+ + OH–; в результате среда становится либо кислой (рН < 7), либо щелочной (рН > 7). 1) Соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону. Реакция среды щелочная (рН > 7). Na2CO3 + HOH ↔ NaHCO3 + NaOH Первая ступень гидролиза: 2) Соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону. Реакция среды кислая (рН < 7). Cu(NO3)2 + HOH ↔ CuOHNO3 + HNO3 Cu2+ + HOH ↔ CuOH+ + H+ 3) Соль, образованная слабым основанием и слабой кислотой, подвергается гидролизу по катиону и аниону. Характер среды определяется константами диссоциации образовавшихся слабых электролитов. CH3COONH4 + HOH ↔ CH3COOH + NH4OH CH3COO– + 4) При совместном гидролизе двух солей образуется слабое основание и слабая кислота: 2 FeCl3 + 3Na2S + 6 H2O = 2Fe(OH)3↓ + 3H2S↑ + 6 NaCl 2 Fe3 + + 2S2– + 6 H2O = 2Fe(OH)3↓ + 3H2S↑ 5) Соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается, реакция среды нейтральная: KNO3 + HOH ≠ Ионы К+ и
|

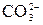 + HOH ↔
+ HOH ↔ 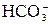 + OH–
+ OH–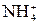 + HOH ↔ CH3COOH + NH4OH
+ HOH ↔ CH3COOH + NH4OH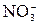 не образуют с водой слабодиссоциирующих продуктов (КОН и НNО3 – сильные электролиты).
не образуют с водой слабодиссоциирующих продуктов (КОН и НNО3 – сильные электролиты).


