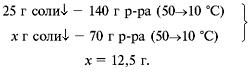Алгоритм 2. Насыщенные растворы
1. Записать, что дано и что необходимо найти.2. Составить первую пропорцию, используя определение коэффициента растворимости Краств 3. Составить вторую пропорцию, исходя из первой и данных задачи:
Решить пропорцию относительно х. Записать ответ (при решении обратных задач составляется такая же схема)Для газов растворимость понижается при нагревании. Растворимость (коэффициент растворимости Kраств) – количество вещества (в г), которое может раствориться в 100 г растворителя при определенной температуре, образуя насыщенный раствор. Пример 1. Коэффициент растворимости соли при температуре 50 °С равен 40 г, при температуре 10 °С составляет 15 г. Определите массу осадка, полученного при охлаждении насыщенного при температуре 50 °С раствора массой 70 г до температуры 10 °С. а) п. 1. Дано: Б) п. 2.
В) п. 3.
Ответ. m (осадка) при охлаждении равна 12, 5 г. Пример 2. При н. у. в воде массой 100 г растворяется хлороводород объемом 50, 5 л. При температуре 50 °С и нормальном давлении коэффициент растворимости хлороводорода равен 59, 6 г. Насыщенный при температуре 0 °С раствор HCl массой 40 г нагрели до температуры 50 °С. Определите массу полученного раствора. а) п. 1. Дано: Б) п. 2.
В) п. 3.
5 г HCl улетучится при нагревании. Ответ. m (полученного р-ра HCl) = 40 – 5 = 35 г. Пример 3. В воде массой 100 г растворяется при температуре 30 °С бромид аммония массой 81, 8 г. При охлаждении насыщенного при температуре 30 °С раствора NH4Br массой 300 г до температуры 0 °С выпадает в осадок соль массой 36, 8 г. Определите, какая масса бромида аммония может быть растворена в воде массой 100 г при t = 0 °С. а) п. 1. Дано: Б) п. 2.
Ответ. K'раств (0 °С) = 59, 5 г. Алгоритм 3. 1. В уравнении окислительно-восстановительной реакции определить элементы, которые меняют степень окисления. – малодиссоциирующие вещества, недиссоциирующие вещества на ионы не расписывают; 3. Записать сокращенное ионное уравнение согласно электронно-ионному балансу: – суммировать процессы окисления и восстановления с учетом равенства электронов в этих процессах; 4. Записать уравнение в молекулярной форме по ионному уравнению, дописать формулы веществ, которые в электронно-ионном балансе не были задействованы. Пример 4. Расставить коэффициенты методом электронно-ионного баланса: H2S + K2Cr2O7 + H2SO4 = S Cr2(SO4)3 + H2O + K2SO4. А) п. 1.
Б) п. 2.
В) п. 3.
г) п. 4, п. 5.Ответ. 3H2S + K2Cr2O7 + 4H2SO4 = 3S + Cr2(SO4)3 + 7H2O + K2SO4. http: //him.1september.ru/ Тексты задач и практических ситуаций для самостоятельного решения при подготовке к итоговой аттестации
|