Лабораторная работа № 3б
Тема: Кинетика Цель работы: Изучить влияние температуры на скорость химической реакции Химические реакции протекающие в растворе:
Нерастворимая сера выделяется в виде мути. Экспериментальная часть: 1. Приготовить пробирки № 1, 2, 3, 4 и налить из бюретки по 5 мл раствора тиосульфата. 2. Приготовить пробирки № 1а, 2а, 3а, 4а и налить по 5 мл раствора серной кислоты. 3. Приготовить 4 стакана с водой. В 1 стакане температура воды комнатная. Во 2 стакане температура выше на 12-130С, чем в первом. В третьем стакане температура выше, чем во втором на 12-130С и в четвертом стакане температура выше, чем в третьем на 12-130С. 4. Поместить в каждый стакан по паре пробирок 1 и 1а, 2 и 2а, 3 и 3а, 4 и 4а и выдержать 5 минут. 5. Слить содержимое пробирок №1 и 1а и отсчитать время протекания реакции. Проделать это с каждой парой пробирок и данные опытов занести в таблицу.
6. Нарисовать графическую зависимость скорости реакции от температуры. На оси абсцисс отложить значение температуры, на оси ординат – скорость.
.Посчитать температурный коэффициент Вант-Гоффа, используя формулу: 7. Сформулировать вывод.
Тест к теме «Кинетика»: 1. Температурный коэффициент реакции равен 3. При охлаждении системы на 20 градусов скорость химической реакции: а. уменьшится в 9 раз б. уменьшится в 3 раза в. увеличится в 9 раз г. уменьшится в 6 раз. 2. Уравняйте уравнения реакций и соотнесите реакции по их суммарному порядку а. 1 порядок б.2 порядок в. 3 порядок г. 4 порядок 1. NaCl → Na++Cl- 2. C2H4 +H2→ C2H6 3. SO2 + O2 → SO3 4. N2 + 3H2→ 2NH3 3. Первый порядок имеет реакция: а. С2Н6 → С2Н4 + Н2 б. С2Н4 + Н2→ С2Н6. в. С2Н2 + 2Н2→ С2Н6 г. 3С2Н2 → С6Н6 4. Второй порядок имеет реакция: а. С2Н4 + Н2→ С2Н6. б. С2Н2 + 2Н2→ С2Н6 в. С2Н6 → С2Н4 + Н2 г. 3С2Н2 → С6Н6 5. Установите соответствие между свободной энергией Гиббса (G) и константой равновесия (Кр): а. Δ G=0 б. Δ G> 0 в. Δ G< 0 1. Кр=1 2. Кр=0, 001 3. Кр=2 4. Кр=0 6. Количественное влияние температуры на скорость химической реакции выражается: а. уравнением Аррениуса б. принципом Ле Шателье в. законом Гесса г. законом действующих масс 7. При повышении давления в системе в 3 раза скорость реакции 2СO + O2 → 2СO2 возрастает в__________ раз. 8. Равновесие экзотермической реакции при повышении температуры смещается в сторону: а. исходных веществ б. продуктов реакции 9. Равновесие реакции N2+3H2→ 2NH3 при повышении температуры смещается в сторону: а. исходных веществ б. продуктов реакции 10. Коферменты входят в состав а. протеинов б. протеидов Примеры решения задач по теме «Кинетика» Задача 1. Напишите выражение для скорости прямой и обратной реакции и уравнение для константы равновесия процесса: 3СО + 7Н2 ↔ С3Н8 + 3Н2О(г) В какую сторону сместится равновесие при повышении давления? Решение. Скорость прямой реакции v=[СО]3 [H]7, суммарный теоретический порядок реакции =10, скорость обратной реакции v=[С3Н8] [H2O]3, суммарный порядок =4. Кр=[С3Н8][H2O]3/[СО]3[H]7. При повышении давления равновесие сместится в сторону образования конечных продуктов реакции, так как число моль газов в ходе прямой реакции уменьшается. Задача 2. Как изменится скорость прямой реакции, если увеличить давление в системе в 4 раза: CO + O2 «CO2? Решение. Уравняем реакцию 2CO + O2 «2CO2. Изменение давления в 4 раза соответствует повышению концентрации газообразных веществ в 4 раза. v1/v=к [4СO]2[4O2]/к [СO]2[O2], где v1- это скорость реакции после изменения условий, а v – начальная скорость реакции. Скорость прямой реакции 2СO + O2 «2СO2, увеличится в 43= в 64 раза. Задача 3. Один из двух одинаковых препаратов хранили на полочке при 25оС, а другой в холодильнике при 5оС. Во сколько раз будет меньше скорость распада препарата при хранении его в холодильнике (γ =3)? Во сколько раз будет меньше скорость распада препарата, если его хранить в морозильной камере при температуре –15оС? Решение. Из закона Вант-Гоффа следует, что: v/vo= γ (25-5)/10=32=9, где vo – это скорость при +5оС, а v – при +25оС v/vo= γ 25-(-15)/10=34=81, где vo – это скорость при -15оС, а v – при +25оС.
Задача4. Время полураспада 20 минут. Рассчитайте константу скорости для реакции первого порядка. Рассчитайте время жизни исходного соединения. Решение. Период полураспада τ =0, 693/k, k=0, 693/ τ = 0, 693/ 20 = 03465(мин)-1 время жизни t=1/k = 1/0, 03456 =28, 935 мин~29 мин. τ =0, 693/t Задача 5. Обратимая реакция описывается уравнением: A+B «C+D. Смешали по 2.5 моля всех веществ (A, B, C и D). После установления равновесия в смеси обнаружено 1, 5 моль вещества C. Найдите константу равновесия. Решенеие. Если [C]=1.5 моль/л, [D] тоже =1.5 моль/л. Δ [C]=1 моль/л Δ [A]= Δ [B]= - 1моль/л, т Тогда [A] = [B] = 2, 5-(-1)моль/л=3, 5 моль/л. Кр=[C][D]
Задачи к теме «Кинетика» для самостоятельного решения:
|

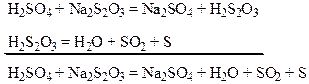

 [A][B]= 1, 5х1, 5
[A][B]= 1, 5х1, 5 


