Выполнение обучающих заданий. Опыт № 1* Адреналиновый отёк легких у мышей
Опыт № 1* Адреналиновый отёк легких у мышей Опыт ставят на двух предварительно взвешенных мышах. Подсчитывают у обоих животных исходную частоту дыхания, обращают внимание на амплитуду дыхательных движений и поведение. Затем одной из мышек (подопытной) внутрибрюшинно вводят 1 мл 0, 1% раствора адреналина. Второй (контрольной) мышке – такой же объём физиологического раствора. Каждые 5-10 минут у животных определяют частоту и амплитуду дыхательных движений, наблюдают изменение окраски глаз и слизистых и замечают время от момента введения адреналина до гибели подопытной мыши (если через 30-40 минут мышь не погибла, то её забивают). Погибшую мышь прикалывают булавками к дощечке, вскрывают грудную клетку и извлекают легкие, которые помещают на часовое стекло. При внешнем осмотре легких обратить внимание на их объём, окраску, наличие кровоизлияний. После этого легкие, освобожденные от трахеи, сердца и мягких тканей, взвесить на аптечных весах и вычислить легочный коэффициент.
Как правило, у подопытной мыши развивается отёк легких. 1. Какие изменения свидетельствуют о развитии отёка легких? 2. Каковы основные патогенетические факторы, вызывающие отёк легких при введении адреналина?
Опыт № 2* Роль функционального состояния центральной нервной системы в развитии адреналинового отёка легких у мышей Подопытная мышь наркотизируется внутрибрюшинным введением 0, 2 мл 1% раствора гексенала. После наступления наркотического сна мышке внутрибрюшинно вводят 1 мл 0, 1% раствора адреналина. Наблюдают и контролируют те же показатели (срок жизни после введения адреналина, частоту и амплитуду дыхательных движений и проч.), что и в опыте №1. Если через 20 минут после введения адреналина наркотизированная мышь не погибнет, то животное забивают и высчитывают легочный коэффициент. Результаты, полученные в опыте №1 и №2, сравнивают, объединяют в виде таблицы и делают соответствующие выводы. 1. Как влияет функциональное состояние центральной нервной системы на развитие экспериментального отека легких?
Опыт № 3 Влияние изменения онкотического давления на развитие отёка и обезвоживания Двух лягушек, обездвиженных разрушением спинного мозга, приколоть на дощечках вверх брюшком. Широко вскрыть грудную клетку и сердечную сорочку, подвести лигатуру под основную ветвь аорты. Канюлю, заполненную физиологическим раствором, вставить в аорту в периферическом (от сердца) направлении и перевязать у шейки лигатурой. Переднюю брюшную стенку разрезать по средней линии до лонного сочленения и далее в стороны, чтобы обеспечить сток жидкости из брюшной полости. Лягушек вместе с дощечкой и канюлей взвешивают и записывают первоначальный вес. Затем одну лягушку при помощи резиновой трубочки подсоединяют к бюретке с физиологическим раствором, другую к бюретке, заполненной лошадиной сывороткой. Уровни жидкостей в обеих бюретках и скорость перфузии должны быть одинаковыми для обеспечения равнозначных условий опыта. Скорость перфузии регулируется винтовым зажимом, который находится на резиновой трубке. Через час после начала перфузии, лягушек отсоединить от бюреток и взвесить. Отметить разницу в весе до и после перфузии физиологическим раствором и сывороткой. Каков механизм развития отёка и обезвоживания у подопытных лягушек?
Опыт № 4 Влияние тканевого осмотического давления на развитие отёка Опыт проводится на двух лягушках. Одной из них в спинной лимфатический мешок вводят 5 мл 10% раствора поваренной соли, другой столько же мл физиологического раствора. Лягушек помещают в разные стаканы и записывают исходный вес, затем в стаканы наливают воду. Через 1-1, 5 часа воду из стаканов выливают и вновь производят взвешивание. Как объяснить изменение веса у лягушки после введения гипертонического раствора?
|

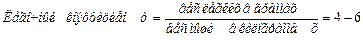 условных единиц у здоровой мыши.
условных единиц у здоровой мыши.


