ЗМЕНШЕННЯ основних властивостей
Na2О MgO А12О3 SiO2 P2O5 SO3 Cl2O7
ЗБІЛЬШЕННЯ кислотних властивостей Таким чином, зліва направо в періодах основні властивості оксидів зменшуються, а кислотні збільшуються. В групах зверху вниз основні властивості оксидів збільшуються, а кислотні зменшуються.
1. Взаємодія простих і складних речовин з киснем:
2. Розкладання деяких кисневмісних речовин (основ, кислот, солей) при нагріванні: Cu(OH)2 – t° ® CuO + H2O (CuOH)2CO3 – t° ® 2CuO + CO2 + H2O 2Pb(NO3)2 – t° ® 2PbO + 4NO2 + O2 2HMnO4 –t°; H2SO4(конц.)® Mn2O7 + H2O 6.3. Основи, їх назви, добування та властивості. Амфотерні гідроксиди ОСНОВИ - це складні речовини, які складаються з атома металу і однієї або кількох гідроксогруп. Загальна формула основ:

1. За розчинністю у воді основи діляться на дві групи:
2. За хімічними властивостями основи діляться на:
ГРАФІЧНІ ФОРМУЛИ ОСНОВ
НАЗВА ОСНОВ складається з трьох слів: 1. Українська назва елементу в родовому відмінку. 2. Валентності елементу. 3. Слова " гідроксид ". Наприклад: Fе(ОН)3 – феруму (III) гідроксид NaOH – натрію гідроксид
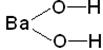
þ АМФОТЕРНІ ГІДРОКСИДИ –це гідроксиди, які залежно від умов проявляють властивості КИСЛОТ або ОСНОВ Zn(ОН)2; Ве(ОН)2; А1(ОН)3; Сr(ОH)3. – здатні віддавати в реакціях з іншими сполуками як йони гідрогену (Н+) так і гідрокси-групи (ОН–): Zn(ОН)2 D H 2Zn O 2 структурна формула H–O–Zn–O–H А1(ОН)3 D Н3АlO3 Сr(ОН)3 D Н3СrO3
● При взаємодії з кислотами амфотерні гідроксиди проявляють властивості ОСНОВ і утворюють катіони солей: Zn(OH)2 + НСl = ZnCl2 + 2Н2O 2А1(ОН)3+ 3H2SO4 = А12(SO4)3 + 6H2O ● При взаємодії з лугами амфотерні гідроксиди проявляють властивості КИСЛОТ і утворюють аніони солей:
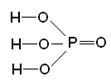
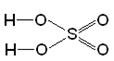
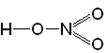
1. Реакції активних металів (лужних і лужноземельних металів) з водою: 2Na + 2H2O ® 2NaOH + H2 Ca + 2H2O ® Ca(OH)2 + H2 2. Взаємодія оксидів активних металів з водою: BaO + H2O ® Ba(OH)2 3. Електроліз водних розчинів солей: 2NaCl + 2H2O ® 2NaOH + H2 + Cl2 4. Нерозчинні у воді гідроксиди одержують реакцією обміну – дією лугу на водні розчини відповідних солей: MgSO4 + 2NaOH = Mg(OH)2¯ + Na2SO4 §6.4. Кислоти, їх класифікація та номенклатура. Добування та властивості кислот Всі кислоти, незалежно від їх походження, об'єднує загальна властивість – вони містять реакційноздатні атоми гідрогену. КИСЛОТИ – це складні речовини, які складаються з катіонів гідрогену, здатних заміщатися на метал, і аніонів кислотного залишку. (З точки зору теорії електролітичної дисоціації: кислоти - електроліти, які при дисоціації в якості катіонів утворюють тільки H+). Загальна формула кислот:

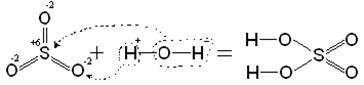
На прикладі сірчаної кислоти розглянемо її утворення з кислотного оксиду SO3 (1), а потім реакцію сірчаної кислоти з магнієм (2). Валентності всіх елементів, що беруть участь в реакції, нам відомі, тому напишемо сполуки у вигляді структурних формул: 1) SO3 + H2O = H2SO4
2) H2SO4 + Mg = MgSO4 + H2
Ці приклади дозволяють легко побачити зв'язок між кислотним оксидом SO3, кислотою H2SO4 і сіллю MgSO4. Одне " народжується" з іншого, причому атом сірки і атоми кисню переходять із сполук одного класу (кислотний оксид) в сполуки інших класів (кислота, сіль).
1). За характером аніону кислоти діляться на:
2). За основністю (кількістю атомів водню, які заміщуються на метал), кислоти діляться на:
** Термін " одноосновна кислота" виник тому, що для нейтралізації однієї молекули такої кислоти потрібна " одна основа", тобто одна молекула якої-небудь найпростішої основи типу NaOH або KOH: HNO3 + NaOH = NaNO3 + H2O HCl + KOH = KCl + H2O Двохосновна кислота вимагає для своєї нейтралізації вже " дві основи", а трьохосновні – " три основи": H2SO4 + 2 NaOH = Na 2 SO4 + 2 H2O H3PO4 + 3 NaOH = Na 3 PO4 + 3 H2O
1). Назва безкисневих кислот, складається з Української назви елементу + " О" + слово " водень" а в кислотному залишку латинська назва елементу + суфікс " ид (ід)" НCl – хлорОводень Сl– – хлорИД H2S – сіркоОводень S–2 – сульфIД 2). Назва кисневмісної кислоти залежить від ступеня окиснення центрального атома. ● Якщо ступінь окиснення максимальний в назві кислоти закінчення – " -на";, а в назві кислотного залишку – " -АТ". H2S+6O4 – сірча на SO4–2 – сульф АТ НNO3 – азот на NO–3 – нітр АТ ● Якщо ступінь окиснення елементу проміжний – в кислоті закінчення – " -иста";, в кислотному залишку – " -ИТ". H2S4+O3 – сірч иста SO–2 – сульф ІТ HNO2 – азот иста NO–2 – нітр ИТ Н3Р+3О3 – фосфор иста НРО32– – гідрофосф ІТ
Кислоти - це рідкі (H2SO4, HNO3) або тверді (Н3РO4, Н3ВО3) речовини. Добре розчинні у воді (крім H2SiO3). Розчини кислот мають кислий смак, рН< 7, проводять електричний струм. Такі кислоти як оцтова (міститься в столовому оцті), яблучна, лимонна, аскорбінова (вітамін С), щавлева і деякі інші (містяться в рослинах) знайомі вам саме своїм кислим смаком. ХІМІЧНІ ВЛАСТИВОСТІ КИСЛОТ 1. Дисоціація кислот: H2SO4 «2Н+ + SO42– Ступенева дисоціація: І. H2SO4 «H+ + HSO4– ІІ. HSO4– «H+ + SO42–
Розчини кислот змінюють колір індикаторів (рН< 7) ІНДИКАТОР – хімічна речовина, яка змінює забарвлення залежно від кислотності (рН) середовища. 2. Кислоти взаємодіють з металами: Кислота + метал = сіль + водень (крім HNO3) Zn + 2HCl = ZnCl2 + H2 (крім HNO3) HNO3 + Сu = Cu(NO3)2 + NO2+ H2О Водень з кислот витісняють тільки ті метали, які у ряді активності стоять зліва від водню (Див. §4.1 – ряд активності металів): 1) метал повинен бути АКТИВНИМ (сильним) по відношенню до кислот. Наприклад, золото (Au), срібло (Ag), ртуть (Hg) та деякі інші метали з кислотами не реагують. Такі метали як кальцій (Ca), цинк (Zn) – навпаки – реагують дуже активно з виділенням газоподібного водню і великої кількості тепла.
За реакційною здатністю відносно кислот всі метали стоять в РЯДІ АКТИВНОСТІ МЕТАЛІВ (табл. 6.1.). Зліва знаходяться найактивніші метали, справа – неактивні. Чим лівіше знаходиться метал у ряді активності, тим інтенсивніше він взаємодіє з кислотами.
Табл. 6.1. Ряд активності металів.
2) кислота повинна бути досить сильною, щоб реагувати навіть з металом з лівої частини табл. 6.1. Під силою кислоти розуміють її здатність віддавати йони H+. Наприклад, кислоти рослин (яблучна, лимонна, щавлева і т.д.) є СЛАБКИМИ кислотами і дуже повільно реагують з такими металами як цинк Zn, хром Cr, залізо Fe, нікель Ni, олово Sn, свинець Pb, (хоча з основами і оксидами металів вони здатні реагувати). З другого боку, такі СИЛЬНІ кислоти як сірчана (H2SO4) або соляна (хлороводнева)(HCl) здатні реагувати зі всіма металами з лівої частини табл. 6.1. У зв'язку з цим існує ще одна класифікація кислот – за силою. В таблиці 6.2. в кожній з колонок сила кислот зменшується зверху вниз.
Таблиця 6.2. Класифікація кислот на сильні та слабкі
þ Особливими є КИСЛОТИ-ОКИСНИКИ – нітратна (HNO3) та сульфатна (H2SO4). При взаємодії металів з нітратною (азотною) кислотою і сульфатною водень не виділяється. Це пов'язано з тим, що нітратна кислота містить в своїй молекулі сильний окисник – Нітроген в ступені окиснення +5. Тому з металами в першу чергу реагує більш активний окисник N+5, а не H+, як в інших кислотах. Cu + 4 HNO3(конц.)=Cu(NO3)2 + 2 NO2 + 2 H2O 3 Cu + 8HNO3(розв.)= 3 Cu(NO3)2 + 2 NO + 4 H2O 8 К + 5 H2SO4(конц.)= 4 K2SO4 + H2S + 4 H2O 3 Zn + 4 H2SO4(конц.)= 3 ZnSO4 + S + 4 H2O
3) Кислоти взаємодіють з основними оксидами. Кислота + основний оксид = сіль + вода H2SO4 + MgO = MgSO4 + Н2О Оскільки основні оксиди – найближчі родичі основ – з ними кислоти також вступають в реакції НЕЙТРАЛІЗАЦІЇ. Як і у випадку реакцій з основами, з основними оксидами кислоти утворюють сіль та воду. Сіль містить кислотний залишок тієї кислоти, яка використовувалася в реакції нейтралізації.
4) Кислоти взаємодіють з основами: Кислота + основа = сіль + вода (реакція НЕЙТРАЛІЗАЦІЇ) Н3РО4 + 3NaOH = Na3PO4 + 3Н2О 2HNO3 + Са(ОН)2 = Ca(NO3)2 + 2Н2О Для реакцій нейтралізації достатньо, щоб хоча б одна з реагуючих речовин була розчинна у воді. Оскільки практично всі кислоти є розчинними у воді, вони вступають в реакції нейтралізації не тільки з розчинними, але і з нерозчинними основами. Винятком є кремнієва кислота, яка погане розчинна у воді і тому може реагувати тільки з розчинними основами – такими як NaOH та KOH: H2SiO3 + 2 NaOH = Na2SiO3 + 2H2O 5) Кислоти взаємодіють з солями, якщо утворюється осад (¯) або газ (): Кислота 1 + сіль 1 = кислота 2 + сіль 2 H2SO4 + ВаCl2 = 2НCl + BaSO4¯ 2НCl + СаСО3 = СO2 + Н2О + СаCl2 6 Деякі кислоти розкладаються при нагріванні: Кислота = кислотний оксид + вода H2SiO3 = SiO2¯ + H2O Н2СО3 = СО2 +- Н2О HNO3 = NO2 + О2+ Н2О
ЗМІНА ВЛАСТИВОСТЕЙ ГІДРОКСИДІВ ЕЛЕМЕНТІВ В ПЕРІОДІ ТА ГРУПІ. ● У періодах: Кислотні властивості гідроксидів елементів одного періоду ЗБІЛЬШУЮТЬСЯ, а основні властивості ЗМЕНШУЮТЬСЯ зліва направо (®).
● У підгрупах: Кислотні властивості гідроксидів елементів однієї підгрупи зверху вниз (¯) ЗМЕНШУЮТЬСЯ, а основні властивості ЗБІЛЬШУЮТЬСЯ. Наприклад:
ЗМІНА ВЛАСТИВОСТЕЙ ВОДНЕВИХ СПОЛУК ЕЛЕМЕНТІВ ● У періодах – основні властивості водневих сполук ЗМЕНШУЮТЬСЯ, а кислотні ЗБІЛЬШУЮТЬСЯ зліва направо (®). Наприклад:
● У підгрупах: –кислотні властивості ЗБІЛЬШУЮТЬСЯ, а основніЗМЕНШУЮТЬСЯ зверху вниз(¯). Наприклад:
§6.5. Солі, їх властивості, класифікація солей, назви і добування солей. Комплексні сполуки СОЛІ – це складні речовини, які складаються з катіонів металу та аніонів кислотного залишку. Солі - це продукти реакції нейтралізації основи кислотою. Загальна формула солей –

1. НОРМАЛЬНІ (СЕРЕДНІ) СОЛІ: КСl, СаСО3, Mg(NO3)2, Са3(РO4)2 – це продукти повної нейтралізації кислоти основою. 3NaOH + Н3РО4 = Na3PO4 + 3Н2О натрію ортофосфат При дисоціації утворюють лише катіони металу (або NH4+) та аміони кислотного залишку Na2SO4 «2Na+ +SO42- CaCl2 «Ca2+ + 2Cl-
2. КИСЛІ СОЛІ: NaHCO3, Mg(HS)2, KH2PO4 – це продукти неповної нейтралізації багатоосновної кислоти основою: КОН + H2SO4 = K H SO4 + Н2О калію гідро сульфат При дисоціації утворюють катіони металу (або NH4+), йони водню та аніони кислотного залишку. NaHCO3 «Na+ + HCO3- «Na+ + H+ + CO32- 3. ОСНОВНІ СОЛІ (ГІДРОКСОСОЛІ): CuOHCl, FeOHSO4 - це продукти неповного заміщення (неповної нейтралізації) групи OH ‾ відповідної основи на кислотний залишок багатокислотної основи кислотою: Са(OH)2 + HF = Са(ОН)F + Н2О кальцію гідроксо фторид Bi(OH)3 + HNО3 = Bi(OH)2NO3 + Н2О бісмуту (Ш) дигідроксонітрат - застосовується в гастроентерології для лікування шлунку. При дисоціації утворюють катіони металу, гідроксид – йони ОН ‾ і аніони кислотного залишку. Zn(OH)Cl «[Zn(OH)]+ + Cl‾ «Zn2+ + OH‾ + Cl‾
4. ПОДВІЙНІ СОЛІ містять два різні катіони та один вид аніону – це продукти нейтралізації одного виду кислоти двома видами основ. K2SО4*А12(SО4)3 = KA1 (SО4)2 калію алюмінію сульфат – застосовується в дерматології як підсушуючий засіб. KOH + A1(OH)3 + 2H2SO4 = KAI(SO4)2 + 4Н2О Nа2SiО3*Сr2(SiО3)3 = NaCr(SiO3)2 натрію хрому (III) силікат NaOH + Сr(ОН)3 + 2H2SiO3 = NaCr(SiO3)2 + 2Н2О 5. ЗМІШАНІ СОЛІ містять різні аніони та один вид катіону – це продукти нейтралізації однієї основи двома кислотами. 2Са(ОН)2 + HF + H3PO4 = Ca2 FPO4 + 4Н3О СаР2: Сa3(РO4)2 = Са2FРO4 кальцію фторид ортофосфат – входить до складу зубної емалі. Са(ОН)2 + НCl + НСlO = СаОCl2 + 2Н2О СаCl2: Са(СlO)2 = СаClC1O кальцію хлорид гіпохлорит – хлорне вапно застосовується для дезинфекції приміщень та посуду. 6. КОМПЛЕКСНІ СОЛІ – це речовини, до складу яких входять складні катіони або аніони. ● речовини, які містять комплексні йони. ● електроліти, які при дисоціації утворюють комплексні йони [Ag(NH3)2]Br «[Ag(NH3)2]+ + Br - Na[Ag(CN)2] «Na+ + [Ag(CN)2]-
Більшість способів добування солей мають в основі взаємодію речовин з протилежними властивостями: 1) метал + неметал: 2Na + Cl2 ® 2NaCl 2) метал + кислотa: Zn + 2HCl ® ZnCl2 + H2 3) метал + розчин солі менш активного металу: Fe + CuSO4 ® FeSO4 + Cu 4) основний оксид + кислотним оксид: MgO + CO2 ® MgCO3 5) основний оксид + кислота: CuO + H2SO4 –t°® CuSO4 + H2O 6) основа + кислотний оксид: Ba(OH)2 + CO2 ® BaCO3¯ + H2O 7) основа + кислота: Ca(OH)2 + 2HCl ® CaCl2 + 2H2O 8) сіль + кислота: MgCO3 + 2HCl ® MgCl2 + H2O + CO2 BaCl2 + H2SO4 ® BaSO4¯ + 2HCl 9) розчин основи + розчин солі: Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯ 10) розчини двох солей: 3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Всі солі – тверді кристалічні речовини. Вони мають різний колір та різну розчинність у воді (див. таблицю розчинності).
Ø СЕРЕДНІ СОЛІ 1. Термічний розклад: CaCO3 –t°® CaO + CO2 2Cu(NO3)2 –t°® 2CuO + 4NO2 + O2 NH4Cl –t°® NH3 + HCl
2. Гідроліз: Al2S3 + 6H2O «2Al(OH)3¯ + 3H2S FeCl3 + H2O «Fe(OH)Cl2 + HCl Na2S + H2O «NaHS +NaOH
3. Реакції обміну з кислотами, основами та іншими солями (тільки якщо утворюється нерозчинна сполука – осад). AgNO3 + HCl ® AgCl¯ + HNO3 Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3 CaCl2 + Na2SiO3 ® CaSiO3¯ + 2NaCl
4. Окисно-відновні реакції, обумовленні властивостями катіона або аніона. 2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Ø Кислі солі 1. Термічний розклад з утворенням середньої солі: Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O 2. Взаємодія з лугом (отримання середньої солі): Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3¯ + 2H2O Ø Основні солі – це речовини, до складу яких входять катіони металу та два різновиди аніонів – аніони кислоти та гідроксид-іони. Наприклад:
В молекулах однокислотних основ (
1. Термічний розклад: [Cu(OH)]2CO3(малахіт) ® 2CuO + CO2 + H2O 2. Взаємодія з кислотою: утворення середньої солі. Sn(OH)Cl + HCl D SnCl2 + H2O
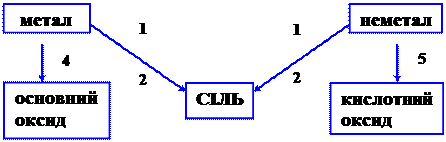
§5.6. Генетичний зв’язок між різними класами неорганічних сполук
Приклади:
|

 основні амфотерний кислотні
основні амфотерний кислотні ОДЕРЖАННЯ ОКСИДІВ
ОДЕРЖАННЯ ОКСИДІВ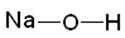

 Zn(OH)2 або H2ZnO2
Zn(OH)2 або H2ZnO2

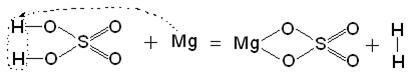

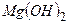

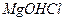 - магній гідроксохлорид
- магній гідроксохлорид
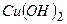

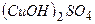 - купрум гідроксосульфат
- купрум гідроксосульфат
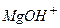

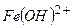
 ферум гідроксо хлорид
ферум гідроксо хлорид

 - ферум ДИгідроксо хлорид
- ферум ДИгідроксо хлорид
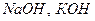 та ін.) є тільки один гідроксид-іон, тобто його НЕ МОЖНА замінити частково. Тому такі основи основних солей не утворюють.
та ін.) є тільки один гідроксид-іон, тобто його НЕ МОЖНА замінити частково. Тому такі основи основних солей не утворюють.