ЗАНЯТТЯ №14
Тема: Окисно-відновні процеси. Окисники та відновники. Значення окисно-відновних реакцій Актуальність: Окисно-відновні реакції лежать в основі дуже важливих процесів в організмі людини: травлення, дихання, біосинтез, зір, процеси обміну речовин і інші. Окисно-відновні процеси в мітохондріях є основним джерелом енергії для життєдіяльності всіх клітин і організму в цілому. Навчальні цілі: Знати: властивості металів і неметалів, можливі ступені окиснення елементів, найважливіші окисники і відновники, типи окисно-відновних реакцій. Уміти: визначати ступені окиснення елементів, окисник і відновник, тип окисно-відновних реакцій, складати електронний баланс. Самостійна позаудиторна робота: ! Написати в робочому зошиті: 1. Визначити ступені окиснення всіх атомів в наступних сполуках: HClO4, HClO3, HClO2, HClO, HCl, Cl2, NH3, PH3, H3PO4, O2, O3. 2.Серед представлених молекул і йонів вибрати ті, які можуть бути: А) тільки відновниками, Б) тільки окисниками, В) можуть проявляти окисно-відновну подвійність: A) Fe, Fe+2, Fe+3, NH3; Б) Cu, Cu+2, CuO, Cu2O; B) Cl2, Сlˉ, Сl+7, Cl2O7; Г) Mn, MnO2, MnO4ˉ, K2MnO4; Д) N2, NO3ˉ, NO2ˉ, NO, Е) S-2, SO3-2 SO4-2, Na2S2O3, Є) HC1, H2S, H2SO4, H2O2,. 3. Скласти електронний баланс і поставити коефіцієнти в окисно-відновній реакції: H2S + H2SO3 ® S + H2O. 4. Розставити коефіцієнти в рівняннях реакцій методом електронного балансу, вказати окисник та відновник, процеси окиснення і відновлення: а) FeSO4 + КМnО4 + H2SO4 ® Fe2(SO4)3 + MnSO4 + K2SO4 + H2O б) H2S + K2Cr2O7 + H2SO4 ® K2SO4 + Сr2(SО4)3 + H2O в) S + КСlO3 + H2O ® Cl2 + K2SO4 + H2SO4 г) NH3 + KMnO4 + КОН ® KNO3 + K2MnO4 + H2O д) As + 5HNO3(конц.) ® H3AsO4 + NO2 + H2O; е) Sb + HNO3(конц.) ® HSbO3 + NO + H2O; є) Bi + HNO3 ® Bi(NO3)3 + NO + H2O; ж) As2S3 + HNO3 ® H3AsO4 + SO2+NO +H2O
6 Дати відповіді на тести 1. Який з процесів відноситься до окисно-відновних? а) кипіння; б) розчинення; в) замерзання; г) згоряння. 2. Вибрати сполуку, в якій ступінь окиснення хрому дорівнює +6: а) K2Cr2O7; б) K2CrO4; в) Cr(OH)3; г) Cr. 3. Вибрати сполуку, в якій ступінь окиснення оксигену дорівнює +2: а) F2O; б) O2; в) H2O; г) CO2. 4. Вибрати сполуку, в якій ступінь окиснення мангану дорів-нює +4: а) KMnO4; б) K2MnO4; в) MnCl2; г) MnO2. 5. Вибрати сполуку, в якій ступінь окиснення феруму дорів-нює +6: а) Fe2O3; б) Fe(OH)2; в) Fe; г) K2FeO4.
6. Який процес відбувається в схемі Са+2 ® Са0? а) окиснення: Са+2 – 2е– ® Са0; б) відновлення: Са+2 + 2 е– ® Са0; в) окиснення: Са+2 + 2 е– ® Са0; г) відновлення: Са+2 2 е– ® Са0. 7. Підібрати характеристику для процесу S–2 ® S+6: а) окиснення: S–2 – 8 е– ® S+6; б) відновлення: S–2 + 8 е– ® S+6; в) окиснення: S–2 – 6 е– ® S+6; г) відновлення: S–2 + 6 е– ® S+6. 8. У якій з речовин сульфур може виявляти тільки окисні властивості? а) K2S; б) H2SO4; в) Na2SO3; г) SO2. 9. У якій з речовин карбон може виявляти тільки відновні властивості? а) CH4; б) CO2; в) CO; г) Na2CO3. 10. У якій з речовин нітроген може виявляти окисно-відновну подвійність? а) HNO2; б) NaNO3; в) N2O5; г) NH3. 11. У якій з речовин манган може виявляти окисно-відновну подвійність? а) Mn2O7; б) KMnO4; в) MnO2; г) Mn. 12. H2S + 8 HNO3 ® H2SO4 + 8 NO2 + 4 H2O. Наведена реакція є: а) міжмолекулярною; б) внутрішньомолекулярною; в) диспропорціонування; г) контрпропорціонування. 11. 2 NaNO3 ® 2 NaNO2 + O2. Наведена реакція є: а) міжмолекулярною; б) внутрішньомолекулярною; в) диспропорціонування; г) контрпропорціонування; 14*. Визначити можливість перебігу окисно-відновної реакції між речовинами: KNO2 і HI: а) реакція не відбувається; б) реакція відбувається: HI – окисник, KNO2 – відновник; в) реакція відбувається: KNO2 – окисник, HI – відновник; г) реакція не відбувається: KNO2 – окисник, HI – окисник.
Контрольні питання 1. Що таке ступінь окиснення? 2. Які ступені окиснення проявляють метали і неметали? 3. Чому метали віддають електрони, а неметали приймають електрони? 4. Чому деякі елементи проявляють окисно-відновну подвійність? З чим це пов'язано? 5. Які реакції називаються окисно-відновними? 6. Що називається окисненням, відновленням? 7. Що таке окисник і відновник? 8. Приведіть приклади найтиповіших окисників і відновників. 9. Які типи окисно-відновних реакцій ви знаєте? Навести приклади? 10. Які фактори впливають на окисно-відновні реакції?
Самостійна робота на занятті ! Написати в робочому зошиті: 1. Визначити ступені окиснення і намалювати структурні формули сполук: H2S, SO2, SO3, F2O2, H2SO4, H2O2, K2MnO4. 2. Визначити ступені окиснення атомів вуглецю в кожній молекулі:
3. Навести формули двох речовин, які можуть проявляти, тільки: а) окиснювальні властивості, б) відновні властивості, в) окисно-відновну подвійність. Написати по одному рівнянню реакцій за участю цих речовин. 4. Скласти електронний баланс для реакцій, вказати окисник і відновник: a) Н2SO3 + HNO3 ® H2SO4 + NO б) (NH4)2Cr2O7 ® Cr2O3 + N2 + 4H2O в) Cl2 + 2KOH ® KClO + KCl + H2O г) 2NO2 + 2KOH ® KNO3 + KNO2 + H2O д) 3HNO2 ® HNO3 + 2NO + H2O е) 3K2MnO4 + 2H2O ® 2KMnO4 + MnO2 + 4KOH є) FeS2+O2 ® Fe2O3 + SO2 ж) 2Pb(NO3)2 ® 2PbO + 4NO2 + O2. 5*. Визначити речовини А та Б в схемі окисно-відновної реакції. Розставити коефіцієнти: KMnO4 + A + H2O ® MnO2 + KNO3 + Б 6*. Є однакова маса цинку і натрію. З якого металу можна одержати більше водню? Навести рівняння реакцій і обґрунтувати відповідь.
РОЗДІЛ 6. КЛАСИ НЕОРГАНІЧНИХ СПОЛУК
План §6.1. Класифікація неорганічних речовин. §6.2. Оксиди, їх склад, назви оксидів, добування, хімічні властивості. §6.3. Основи, їх назви, добування та властивості. Амфотерні гідроксиди. §6.4. Кислоти, їх класифікація та номенклатура. Добування та властивості кислот. §6.5. Солі, їх властивості, класифікація солей, назви і добування солей. Комплексні сполуки. §6.6. Генетичний зв'язок між різними класами неорганічних сполук.
§6.1. Класифікація неорганічних речовин
§6.2. Оксиди, їх склад, назви оксидів, добування, хімічні властивості
Загальна формула оксидів ЕхОу; де Е – елемент, х та у – індекси.
Основним оксидам відповідають ОСНОВИ, кислотним – КИСЛОТИ, амфотерним – і ті й інші.
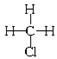
НАЗВА ОКСИДІВ складається з трьох слів: 1. Українська назва елементу в родовому відмінку. 2. Валентності елементу. 3. Слова " оксид". Наприклад: Fе2О3 - ферум (III) оксид Мn2О7 - мангану (VII) оксид ГРАФІЧНІ ФОРМУЛИ Графічні формули показують порядок сполучення атому з іншими атомами в молекулі та валентність атомів. Правила написання графічних формул: 1. Атом Оксигену завжди двовалентний (─ О ─) 2. Атоми Оксигену не з'єднуються один з одним, окрім пероксидів Н2О2 (Н─ О─ О─ Н), ВаО2. 3. Атоми одного елементу не з'єднуються один з одним.
þ Коротко основні хімічні властивості оксидів можна представити у вигляді таблиці:
У періодах властивості оксидів змінюються від основних через амфотерні до кислотних. Наприклад, розглянемо властивості оксидів елементів третього періоду:
|












 КЛАСИФІКАЦІЯ ОКСИДІВ:
КЛАСИФІКАЦІЯ ОКСИДІВ:
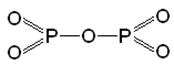

 SO3 + СаО = CaSO4
H2SO4
3) Кислотний оксид + основа =: сіль + Н2О
SO3 + СаО = CaSO4
H2SO4
3) Кислотний оксид + основа =: сіль + Н2О
 SiO2 + 2 NaOH = Na2SiO3 + H2O
H2SiO3
SiO2 + 2 NaOH = Na2SiO3 + H2O
H2SiO3



