Опухоли Т2-Т4 прорастают в мышечный слой и распространяются за пределы мочевого пузыря. В связи с этим они получили название мышеч-но-инвазивный РМП
N (nodulus) - регионарные лимфатические узлы: Nx - регионарные лимфатические узлы не могут быть оценены; N0 - нет метастазов в регионарные лимфатические узлы; N1 - метастазы размером 2 см или менее в единственном лимфатическом узле; N2 - метастазы размером более 2 см, но не более 5 см в единственном или множественных лимфатических узлах; N3 - метастазы в лимфатический узел размером более 5 см.
Рис. 11.21. Степень инвазии опухоли Т в стенку мочевого пузыря M(metastases) - отдаленные метастазы: Мх - отдаленные метастазы не могут быть оценены; М0 - нет отдаленных метастазов; М1 - обнаружены отдаленные метастазы. Выявление регионарных (N1-N3) и отдаленных метастазов (М1) указывает на наличие метастатического РМП независимо от степени инвазии (любая Т). Классификация ВОЗ степени анаплазии переходно-клеточного РМП (2004): Уротелиальная папиллома. Папиллярная уротелиальная опухоль с низким потенциалом злокачественности. Высокодифференцированный папиллярный уротелиальный рак. Низкодифференцированный папиллярный уротелиальный рак. Уротелиальная папиллома - доброкачественное новообразование без риска прогрессирования (встречается чаще в молодом возрасте). В отдельную группу выделены папиллярные опухоли с минимальным нарушением клеточной архитектоники и минимальной атипией ядер, имеющие низкий потенциал злокачественности. Несмотря на малую вероятность про-грессирования, наличие риска рецидивирования делает необходимым тщательное наблюдение за этими больными (рекомендация ВОЗ). Патоморфологическая классификация рTNM используется по результатам исследования операционного препарата. В клинической практике широко применяется разделение опухоли по степени клеточной дифференцировки или гистопатологической градации G, которая имеет большое значение для определения тактики лечения и прогноза заболевания. В настоящее время всеобщее признание получила двухстепенная градация клеточной атипии: высоко-и низкодифференцированная. Симптоматика и клиническое течение. На ранних стадиях РМП у большинства больных протекает бессимптомно. Как правило, первым и наиболее характерным проявлением болезни является микро-, а чаще макрогематурия, которая может быть терминальной, тотальной, однократной, постоянной и эпизодической. Степень кровотечения не зависит от величины и стадии опухоли. Массивная и длительная макрогематурия может привести к тампонаде мочевого пузыря сгустками крови и вызвать анемизацию больного. Важным симптомом РМП является дизурия, которая наиболее часто проявляется в виде поллакиурии, странгурии, императивных позывов и острой задержки мочеиспускания. Она возникает вследствие уменьшения емкости мочевого пузыря за счет опухоли, раздражения рецепторного аппарата в результате прорастания стенки, присоединения инфекции и обтурации просвета уретры флоттирующей опухолью или сгустками крови. Боли у больных РМП в основном локализуются в надлонной и крестцовой области, носят разнообразный характер и зависят от стадии. По мере инвазии опухоли в мышечную стенку и за ее пределы боль становится более выраженной, постоянной и иррадиирует в пораженные соседние органы малого таза (прямую кишку, влагалище, простату). Боль в поясничной области возникает при нарушении оттока мочи из почек в результате обструкции устьев и предпузырных отделов мочеточников растущей опухолью с развитием гидроуретеронефроза. Присоединение хронического пиелонефрита приводит к хронической почечной недостаточности. При метастазировании в кости боль появляется в местах локализации опухолевых очагов. Прогрессирование заболевания сопровождается общей слабостью, быстрой утомляемостью, снижением аппетита, похуданием, что связано с распространением опухолевого процесса и явлениями хронической почечной недостаточности. Диагностика основана на характерных жалобах, анамнезе и объективных данных. При осмотре оценивают общее состояние больного, обращают внимание на цвет кожных покровов, который приобретает бледный оттенок при постгеморрагической анемии или наличии метастазов в костном мозге (токсическая анемия). Тампонада мочевого пузыря или опухоль больших размеров приводят к задержке мочи, и выбухающий при этом над лоном перерастянутый мочевой пузырь легко определяется визуально и пальпаторно. Появление отека нижних конечностей свидетельствует о метастатическом поражении тазовых лимфатических узлов. Важную информацию дает бимануальная пальпация, которую проводят под наркозом с опорожненным мочевым пузырем после цистоскопии и биопсии опухоли. При исследовании определяют подвижность опухоли между указательным пальцем левой руки, введенным в прямую кишку у мужчин или во влагалище у женщин, и правой ладонью, расположенной на передней стенке живота над лоном. Фиксированная опухоль свидетельствует о ее прорастании в органы малого таза (Т4). В анализах крови определяются: анемия, повышение СОЭ, азотемия. В моче присутствует большое количество эритроцитов, а при наличии инфекции - лейкоциты, отмечается ложная протеинурия. Цистологическое исследование осадка мочи обладает чувствительностью до 50 % и высокой специфичностью (до 95-100, 0 %). Информативность метода снижается при высокодифферен-цированных опухолях, сопутствующем воспалении, гематурии и бактериурии. Его рекомендуется использовать для скрининга, в диагностике первичного рака и контроля за результатами лечения. Опухолевые маркеры (BTA-stat, NMP-22, UBC и др.) пока не нашли широкого практического применения. Наиболее перспективным является метод флюоресцентной гибридизации in situ (FISH-диагностика), основанный на выявлении в клетках слущенного уротелия хромосомных аномалий, характерных для РМП. В отличие от цитологического метода его чувствительность достигает почти 100, 0 % независимо от степени инвазии и дифференцировки опухоли. УЗИ благодаря своей широкой доступности, простоте, малой инвазивности, безопасности и высокой точности стало одним из основных методов раннего выявления РМП, определения стадии заболевания и послеоперационного контроля за возможными рецидивами опухоли. С этой целью используют трансабдоминальный, трансректальный, трансвагинальный и в редких случаях трансуретральный датчики. Экзофитные опухоли мочевого пузыря на сонограммах представляют собой образования различных размеров с неровными контурами и неоднородной структуры, вдающиеся в просвет мочевого пузыря. Поверхностные (немышечно-инвазивные) опухоли выглядят небольшими по размеру, не рас-
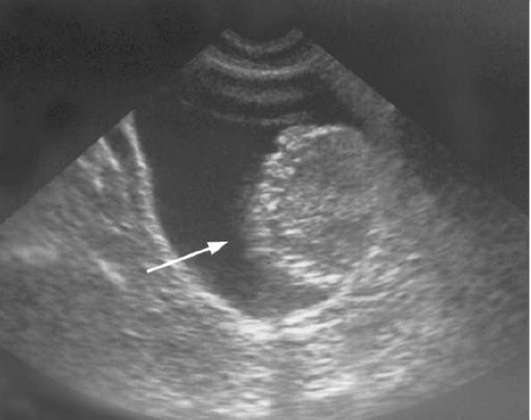
Рис. 11.22. Сонограмма. Поверхностная (немышеч-но-инвазивная) опухоль мочевого пузыря (стрелка)
Рис. 11.23. Сонограмма. Мышечно-инвазивная опухоль мочевого пузыря (стрелка) пространяющимися на мышечный слой стенки мочевого пузыря (рис. 11.22). Мышечно-инвазивные образования, как правило, большие по объему с широким, внедряющимся в стенку мочевого пузыря основанием (рис. 11.23). При локализации в области устья они могут сдавливать его или прорастать, вызывая обструкцию мочеточника с развитием гидроуретеронефроза (рис. 11.24). Трансректальная сонодоплерография позволяет выявить степень ангиогенеза опухоли (рис. 63, см. цв. вклейку).
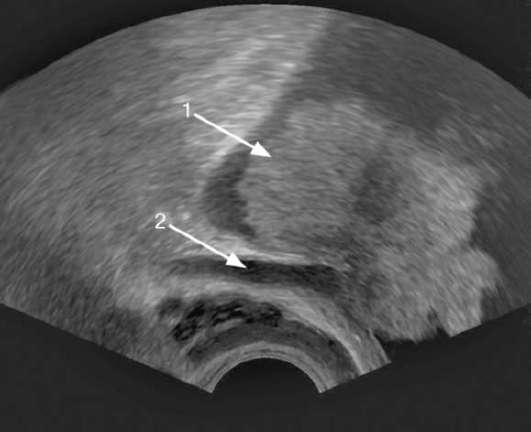
Рис. 11.24. Сонограмма. Мышечно-инвазивная опухоль мочевого пузыря (1) с прорастанием устья и расширением мочеточника (2)
Рис. 11.25. Сонограмма. Инвазия опухоли мочевого пузыря (1) в предстательную железу (2)
Рис. 11.26. Экскреторная урограмма с нисходящей цистограммой. Опухоль мочевого пузыря (стрелка) Эндофитные мышечно-инвазивные опухоли, распространяющиеся на па-равезикальную клетчатку и предстательную железу при наполнении, придают мочевому пузырю неправильную асимметричную форму с изъеденным контуром (рис. 11.25). Посредством сонографии можно выявить увеличенные лимфатические узлы, оценить уродинамику верхних мочевых путей, размеры, толщину и структуру почек. По своей разрешающей способности УЗИ с трехмерным изображением (3D-формат) не уступает МРТ, КТ и позволяет обнаружить опухоли размером до 5 мм и довольно точно определить степень инвазии Т. При комбинированном ультразвуковом сканировании с использованием различных датчиков чувствительность метода достигает 95 %. Пациентам, не переносящим контрастное вещество, она может в известной степени заменить экскреторную урографию. Экскреторная урография позволяет выявить уровень нарушения оттока мочи из почек, судить об их раздельном функциональном состоянии и по дефекту наполнения обнаружить опухоли в верхних мочевых путях. Наличие гидро-уретеронефроза указывает на сдавливание или инвазию устья и предпузыр- ного отдела мочеточника опухолью. На нисходящей цистограмме появляются дефекты наполнения с неровными, изъеденными контурами и асимметрия контура мочевого пузыря (рис. 11.26). КТ и МРТ наиболее информативны и в настоящее время широко используются в диагностике РМП, стадировании заболевания и обнаружении пораженных регионарных лимфатических узлов. Эти исследования позволяют различить анатомические слои стенки мочевого пузыря и с высокой точностью определить степень инвазии Т в них опухоли. Экзофитные опухоли при КТ выявляются в виде внутрипузырных
Рис. 11.27. КТ. Мышечно-инвазивная экзофитная опухоль мочевого пузыря (стрелка)
Рис. 11.28. КТ. Мышечно-инвазивная инфильтративная опухоль мочевого пузыря (стрелка) образований различных размеров с неровными контурами (рис. 11.27), а эндофитные - на фоне контрастирования создают картину «срезанной» стенки мочевого пузыря с неровными контурами (рис. 11.28). Аналогичные изменения определяются и при МРТ (рис. 11.29). Уретроцистоскопия под наркозом с биопсией измененных участков уро-телия является основным методом диагностики и определения стадии РМП. Поверхностные немышечно- инвазивные опухоли определяются как нежно-ворсинчатые на тонкой ножке или с небольшим основанием образования с хорошо видимыми питающими их сосудами (рис. 23, см. цв. вклейку). Мышечно-инвазивные опухоли значительно больших размеров, имеют грубые ворсинки и широкое основание (рис. 24, см. цв. вклейку). Поверхность их может быть с участками кровоизлияний, некрозов и инкрустаций. Слизистая оболочка вокруг их основания гипереми-рована, отечна, с хорошо видимыми расширенными венозными сосудами. Результаты цистоскопии с указанием вида, локализации, размеров и количества опухолей отображаются на графической диаграмме мочевого пузыря. Макрогематурия является неотложным показанием к цистоскопии для выявления источника кровотечения. Многофокусная биопсия с последующим гистологическим исследованием материала позволяет наиболее точно определить тип, степень инвазии и дифференцировки опухоли. Цистоскопия в обычном свете и лучевые методы обследования не позволяют выявлять папиллярные образования менее 0, 3 см в диаметре и плоские опухоли (рак in situ). С этой целью применяется флюоресцентная цистоскопия (фотодинамическая диагностика), с помощью которой можно обнаружить поверхностный
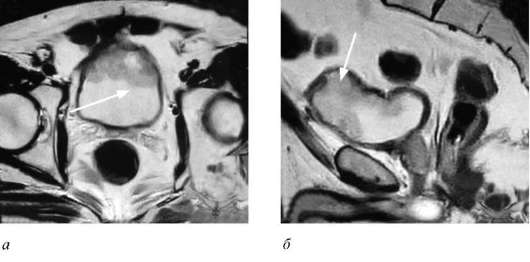
Рис. 11.29. МРТ: а - аксиальная проекция; б - сагиттальная проекция. Мышечно-инвазивная опухоль мочевого пузыря (стрелки) рак (СIS, Та, Т1) у 97 % больных. Она проводится при освещении полости мочевого пузыря сине-фиолетовым светом после предварительного внутрипузыр-ного введения 5-аминолевуленовой кислоты, избирательно накапливающейся в опухолевых клетках. В результате наступает флюоресценция опухолевых тканей, невидимых при обычной цистоскопии. Метод широко используется не только для ранней диагностики первичных и рецидивных опухолей, но и для более точного определения их границ во время ТУР (рис. 26, см. цв. вклейку). Метастатические поражения лимфатических узлов и органов выявляются с помощью лучевых методов диагностики, а костные изменения - путем рентгенографии и остеосцинтиграфии. Дифференциальный диагноз опухоли мочевого пузыря следует проводить с хроническими воспалительными процессами в мочевом пузыре: туберкулезом, простой язвой, эндометриозом мочевого пузыря, хроническим геморрагическим, интерстициальным и гранулематозным циститом. Туберкулезные гранулемы или туберкулезные язвы сочетаются со специфическими изменениями почки и мочеточника, а в моче находят большое количество лейкоцитов и микобактерии туберкулеза. Простая язва мочевого пузыря отличается отсутствием инфильтративного роста. При поздних стадиях РМП следует исключить прорастание опухолей из соседних органов: толстой кишки, шейки матки, влагалища, предстательной железы. Любые подозрительные опухолевидные образования (лимфома, лейо-миома, нефрогенная аденома и др.), метаплазия эпителия (лейкоплакия, мала-коплакия) требуют выполнения биопсии для верификации диагноза. Наличие опухоли возле устья мочеточника заставляет исключить новообразования верхних мочевых путей, имплантационно распространившиеся в мочевой пузырь. Лечение РМП комбинированное и направлено на радикальное удаление опухоли, предупреждение рецидивов, метастазирования и прогрессирования заболевания. Основным методом является оперативное лечение. Хирургическая тактика принципиально отличается у больных с поверхностным и мышечно-инвазивным РМП. Основными прогностическими факторами, определяющими риск прогрессирования заболевания, являются степень инвазии Т и дифференцировки G опухоли, их количество, размер и скорость рециди-вирования после удаления, наличие фокусов рака in situ (CIS). В зависимости от них пациенты с поверхностным (неинвазивным) РМП делятся на группы с высоким и низким риском прогрессирования заболевания. Carcinoma in situ (CIS), в отличие от других видов поверхностных опухолей (Та, Т1), всегда имеет низкую дифференцировку и может встречаться в ассоциации с основным новообразованием, что нередко требует выполнения радикальной цистэктомии. Трансуретральная электрорезекция стенки мочевого пузыря с опухолью в пределах здоровых тканей с последующей внутрипузырной иммуноили химиотерапией является основным методом лечения больных поверхностным (неинвазивным) РМП. Операция заключается в последовательном срезании участков опухоли петлей резектоскопа вплоть до ее основания (рис. 25, см. цв. вклейку). Кровоточащие сосуды коагулируют. Основание резецируют вместе с мышечным слоем мочевого пузыря по окружности, отступя от опухоли 1, 5-2 см, и в отдельной емкости отправляют на гистологическое исследование. Для того чтобы не про- пустить опухоли менее 0, 2-0, 3 см в диаметре и рак in situ, ТУР выполняют под флюоресцентным контролем (рис. 26, см. цв. вклейку). Характерной особенностью РМП является высокая частота рецидивов после ТУР - они возникают у 40-70 % больных в разные сроки послеоперационного периода. Именно поэтому пациентам с низким риском сразу (не позже 24 часов) после ТУР выполняется однократная профилактическая внутрипузырная инстилляция химиопрепарата (митомицин С), которая уменьшает скорость рецидивирования опухоли в 2 раза. При высоком риске в послеоперационном периоде с целью профилактики рецидивов назначается адъювантная внутрипу-зырная иммуноили химиотерапия. Внутрипузырная иммунотерапия проводится вакциной БЦЖ в течение 6 недель (1 раз в 7 дней) в дозе 75-120 мг с последующей ежемесячной инстилляцией. БЦЖ-терапия является самым эффективным методом профилактики рецидивов поверхностного РМП, однако сопровождается рядом осложнений. У большинства пациентов развивается цистит, частота которого возрастает с увеличением числа инстилляций и дозы вводимого препарата. Среди общих осложнений наиболее часто наблюдается лихорадка, обычно не превышающая 38, 5 °С. Купирование гипертермической реакции достигается приемом традиционных жаропонижающих средств, и в первую очередь парацетамола. Поводом к прекращению инстилляций - временно или окончательно - могут послужить сохраняющаяся более двух суток лихорадка, полиорганные боли, отчетливо выраженное недомогание, боли в суставах и кожные высыпания. При неэффективности внутрипузырной иммуноили химиотерапии используется фотодинамическая терапия в профилактическом режиме. После внутривенного введения фотосенсибилизатора (фотогема) производится облучение слизистой оболочки мочевого пузыря лазерным зондом. Поверхностные низко- и недифференцированные опухоли, поражающие весь уротелий (мультифокальный рост), часто и быстро рецидивирующие, в сочетании с ракомin situ или с тенденцией к прогрессированию являются показанием к их удалению вместе с мочевым пузырем, то есть к радикальной цистэктомии. Лечение мышечно-инвазивного РМП более сложное. Оно заключается в соче-танном или раздельном применении хирургического, химио- и/или лучевого лечения. Органосохраняющее оперативное лечение (ТУР стенки мочевого пузыря с опухолью и его открытая резекция) хотя и позволяет сохранить мочевой пузырь, не является радикальным и применяется в комбинации с адъювантной химио- и лучевой терапией у пожилых пациентов с тяжелым соматическим статусом и в связи с продолжающимся кровотечением. Рецидивы опухоли после открытой резекции мочевого пузыря по поводу мышечно-инвазивного рака возникают у 50-80 % больных. Цистэктомия с различными методами деривации мочи является основным и единственным радикальным методом лечения больных инвазивным РМП. Радикальная цистэктомия включает удаление мочевого пузыря с участком прилегающей брюшины и паравезикальной клетчаткой, регионарных лимфоузлов, предстательной железы и семенных пузырьков (у мужчин), яичников, маточных труб, матки и передней стенки влагалища (у женщин) (рис. 71, 80, см. цв. вклейку). В настоящее время в клиниках, имеющих большой опыт выполнения данной операции, удалось добиться низкой послеоперационной летальности, не превышающей 2-3 %, а ранние и поздние осложнения уменьшить до 25-30 %. После удаления мочевого пузыря возникает проблема отведения мочи. В настоящее время выделяют следующие методы надпузырной деривации мочи: ■ пересадка мочеточников в непрерывный кишечник (сигмовидную кишку) - билатеральный уретеросигмоанастомоз; ■ формирование наружных мочевых свищей с постоянным выделением мочи (влажная уростома). К ним относятся: двусторонняя уретерокутанеос-томия или уретероилеокутанеостомия (операция Бриккера); ■ гетеротопическая цистопластика - создание в брюшной полости кишечного резервуара для мочи с выводом его на кожу, способного удерживать мочу за счет специально сформированного клапана (сухая уростома). У этих пациентов отсутствует подтекание мочи. Ее они должны периодически выпускать катетером через имеющийся кожный свищ; ■ ортотопическая цистопластика - создание из различных отделов желудочно-кишечного тракта искусственного мочевого пузыря, соединенного с мочеиспускательным каналом, что позволяет больному самостоятельно мочиться. Последний метод является наиболее эффективным как в медицинском, так и социальном аспекте и широко распространен во всем мире. Чаще всего с этой целью используется участок подвздошной кишки на брыжейке, который S-об-разно укладывают, рассекают по антибрыжеечному краю (детубуляризируют) и сшивают с образованием округлого резервуара, по форме напоминающего мочевой пузырь. С боков в него имплантируют мочеточники и соединяют с мочеиспускательным каналом. Детубуляризация и реконфигурация сегмента кишки позволяют создать искусственный мочевой пузырь достаточной емкости и низкого давления, что позволяет осуществлять контролируемое самостоятельное мочеиспускание по уретре и значительно уменьшает вероятность недержания мочи (рис. 72-76, см. цв. вклейку). Дистанционная лучевая терапия в качестве самостоятельного метода применяется при уротелиальных мышечно-инвазивных опухолях, но по своей эффективности уступает радикальной цистэктомии. Системная химиотерапия как составное звено комплексного лечения злокачественных опухолей мочевого пузыря предусматривает внутривенную либо внутримышечную доставку цитостатических веществ различной природы. В системной химиотерапии переходно-клеточного РМП использован принцип полихимиотерапии. Наиболее действенной оказалась комбинация M-VAC (ме-тотрексат, винбластин, адриамицин, цисплатин). В последнее десятилетие стали применять не уступающий по эффективности и значительно менее токсичный гемцитабин трифосфат. Другой активной группой препаратов для лечения РМП являются таксоиды, представляющие новый класс антинеопластичес-ких лекарств со сходным механизмом действия, - паклитаксел и доцетаксел. В отдельных случаях лучевую или системную полихимиотерапию используют в пред- и послеоперационном периодах для уменьшения размеров, инвазии опухоли и профилактики местных рецидивов. Прогноз. После ТУР поверхностных опухолей мочевого пузыря больные проходят регулярные, раз в 3 месяца, обследования в течение первого года. Им выполняют УЗИ мочевого пузыря и цистоскопию с мультифокальной биопсией слизистой. В последующем при отсутствии рецидивов интервал между обследованиями увеличивают до 6 месяцев и более. Пятилетняя выживаемость после ТУР поверхностных опухолей с последующей адъювантной химиоили БЦЖ-терапией составляет 80-98 %. Больные, перенесшие радикальную цис-тэктомию по поводу инвазивного РМП, также должны находиться под постоянным диспансерным контролем. Пятилетняя выживаемость их зависит от установленной патологоанатомической стадии опухоли и составляет при pTis- pT1 - 70-95 %, pT2 - 60-70 %, pT3 - 30-50 % и pT4 - 20-25 %.
|