Гидролитическое дезаминирование
Преобладающим является окислительное дезаминирование.
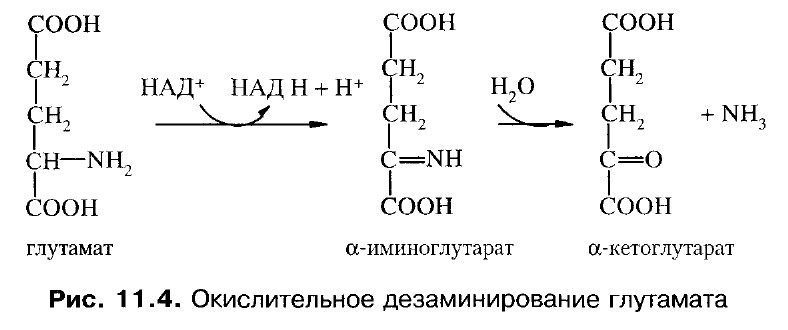
С наибольшей скоростью дезаминируется глутаминовая кислота. Глутаматдегидрогеназа - анаэробный фермент. Ее коферменты – НАД+ или НАДФ+. Сначала глутамат окисляется в иминоглутарат при участии глутаматдегидрогеназы, а затем иминокислота гидролизуется с образованием α -кетоглутарата и аммиака.
Гистидин подвергается внутримолекулярному дезаминированию.
уроканиновая кислота 2. Трансаминирование аминокислот - реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α -кетокислоту. БольшинствоL-аминокислот дезаминируется в организме путем трансаминирования (переаминирования) с α -кетоглутаровой кислотой:
Ферменты - аминоферазы, или трансаминазы. Они содержатся практически во всех органах, но наиболее активно реакции трансаминирования протекают в печени. Их кофермент - пиридоксальфосфат (производное витамина В6). Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию. А. Е. Браунштейн для подобного непрямого пути дезаминирования аминокислот предложил термин трансдезаминирование. Для клинических целей наибольшее значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ), катализирующие перенос аминогруппы с аспартата и аланина на a-кетоглутарат: аспартат + α -кетоглутарат ® оксалоацетат + глутамат аланин + α -кетоглутарат ® пируват + глутамат В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Уже через 3- 5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Уровень АлАТ в крови повышается при заболеваниях печени.
|



 ®
® 




