РАЗДЕЛ II. МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Основные формулы 33. Количество вещества однородного газа (в молях):
где N - число молекул газа; NА - число Авогадро; m - масса газа; μ - молярная масса газа. Если система представляет смесь нескольких газов, то количество вещества системы
или
где ni, Ni, mi, μ i - соответственно количество вещества, число молекул, масса, молярная масса i-й компоненты смеси. 34. Уравнение Клапейрона - Менделеева (уравнение состояния идеального газа):
где m - масса газа; μ - молярная масса газа; R - универсальная газовая постоянная; 35. Опытные газовые законы, являющиеся частными случаями уравнения Клайперона—Менделеева для изопроцессов: а) закон Бойля—Мариотта (изотермический процесс - T=const; m=const): pV=const, или для двух состояний газа: p1V1=p2V2, где p1 и V1 - давление и объем газа в начальном состоянии; p2 и V2 - те же величины в конечном состоянии; б) закон Гей-Люссака (изобарический процесс - p=const, m =const): V/T=const или для двух состояний: V1/T1=V2/T2 где V1 и T1 - объем и температура газа в начальном состоянии; V2 и T2 - те же величины в конечном состоянии; в) закон Шарля (изохорический процесс - V=const, m=const); p/T=const, или для двух состояний: p1/T1=p2/T2, где p1 и T1 - давление и температура газа в начальном состоянии; p2 и Т2 - те же величины в конечном состоянии; г) объединенный газовый закон (m=const): pV/T=const, p1V1/T1=p2V2/T2, где p1, V1, T1 - давление, объем и температура газа в начальном состоянии; р2, V2, T2 - те же величины в конечном состоянии. 36. Закон Дальтона, определяющий давление смеси газов: p = p1+p2+…+pn, где pi - парциальные давления компонент смеси; n - число компонентов смеси. 37. Молярная масса смеси газов:
где mi - масса i-го компонента смеси; 38. Массовая доля ω i-го компонента смеси газа (в долях единицы или процентах): ω i=mi/m, где m - масса смеси. 39. Концентрация молекул (число молекул в единице объема):
где N - число молекул, содержащихся в данной системе; p - плотность вещества. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества. 40. Основное уравнение кинетической теории газов:
где < ω n> - средняя кинетическая энергия поступательного движения молекулы. 41. Средняя кинетическая энергия поступательного движения молекулы:
где k - постоянная Больцмана. 42. Средняя полная кинетическая энергия молекулы:
где i - число степеней свободы молекулы. 43. Зависимость давления газа от концентрации молекул и температуры: p=nkT. 44. Скорости молекул:
где mi - масса одной молекулы. 45. Относительная скорость молекулы
где u - скорость данной молекулы. 46. Удельные теплоемкости газа при постоянном объеме и при постоянном давлении.
47. Связь между удельной (c) и молярной (C) теплоемкостями
48. Уравнение Роберта Майера:
49. Внутренняя энергия идеального газа
50. Первое начало термодинамики: Q = Δ U+A, где Q - теплота, сообщенная системе (газу); Δ U - изменение внутренней энергии системы; А - работа, совершенная системой против внешних сил. 51. Работа расширения газа:
где γ =Cp/CV - показатель адиабаты. 52. Уравнения Пуассона, связывающие параметры идеального газа при адиабатическом процессе:
53. Термический к.п.д. цикла:
где Q1 - теплота, полученная рабочим телом от нагревателя; Q2 - теплота, переданная рабочим телом охладителю. 54. Термический к. п. д. цикла Карно:
где T1 и Т2 - термодинамические температуры нагревателя и охладителя. 55. Коэффициент поверхностного натяжения
где F - сила поверхностного натяжения, действующая на контур 56. Формула Лапласа, выражающая давление p, создаваемое сферической поверхностью жидкости: p=2α /R. где R - радиус сферической поверхности. 57. Высота подъема жидкости в капиллярной трубке:
где θ - краевой угол (θ =0 при полном смачивании стенок трубки жидкостью; θ =p при полном несмачивании); R - радиус канала трубки; r - плотность жидкости; g - ускорение свободного падения. 58. Высота подъема жидкости между двумя близкими и параллельными друг другу плоскостями:
где d - расстояние между плоскостями.
РАЗДЕЛ III. ЭЛЕКТРОСТАТИКА. ПОСТОЯННЫЙ ТОК
|


 ,
, ,
,
 - количество вещества; Т - термодинамическая температура Кельвина.
- количество вещества; Т - термодинамическая температура Кельвина.
 - количество вещества i-го компонента смеси; n - число компонентов смеси.
- количество вещества i-го компонента смеси; n - число компонентов смеси.




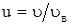 ,
,
 .
. .
. .
.





 , ограничивающий поверхность жидкости; Δ E - изменение свободной анергии поверхностной пленки жидкости, связанное c изменением площади Δ S поверхности этой пленки.
, ограничивающий поверхность жидкости; Δ E - изменение свободной анергии поверхностной пленки жидкости, связанное c изменением площади Δ S поверхности этой пленки.
 ,
,


