Дәріс. Қарапайым, қатарласқан гомогенді және гетерогенді аналитикалық реакциялар тепе-теңдігінің термодинамикасы.
Дәрістер. Күшті және әлсіз қышқылдардың (негіздердің) өте сұйытылған ерітінділерінің қышқылдығын анықтайтын факторлар мен процесстер.
Концентрациясы 10-6 М төмен күшті қышқылдар мен негіздердің өте сұйытылған ерітінділері үшін рН есептегенде су диссоциациясын ескеру қажет. Бірнегізді күшті қышқыл үшін электрбейтараптық теңдеуді құрамыз: [H+] = [OH-] + [An-] (26) Күшті қышқыл және еріткіш – су диссоциациясы процестеріне сүйене отырып: НА ® Н+ + А-; Н2О Û Н+ + ОН- [A-]=CHA, күшті қышқыл болғандықтан толық диссоциацияланады. (26) теңдеуден: [OH-] = [H+] - [An-] = [H+] - CHCl (27) (27) теңдеуді судың иондық туындысының теңдеуіне қоямыз: КН2О = [H+][OH-] = [H+]([H+] - CHCl) Теңдеудің барлық мүшесін сол жаққа ауыстырамыз: [H+]2 - [H+].CHCl - KH2O = 0
10-8 М HCl ерітіндінің рН-ын (28) теңдеумен есептейміз:
pH = -lg 1,05.10-7 = 6,98 pH = 6,98. Тұз қышқылының өте сұйылтылған ерітіндісі қышқылдығын есептегенде еріткіш үлесін ескермесе мүмкін емес жауап рН = 8,0 болар еді.
Диссоциация дәр е жесі төмен әлсіз қышқылдар (негіздер)
Әлсіз қышқылдар жарым-жартылай диссоциацияланады: НА Û Н+ + А- Қышқылдың ионизация процесі диссоциация константасымен сипатталады:
СНА³103 К болғанда, қышқыл диссоциациясының аз дәрежесінде [HA]дбаған»СНА деп болжауға болады. [H+] = [A-] болғандықтан КНА =
рН есептеу үшін бұл теңдеуді диссоциация дәрежесі 5%-дан төмен қышқылдарға қолданады: СН3СООН, Н3ВО3, Н2S, Н2СО3, бензой, валериан, май, фенилсірке, пропион, синиль және т.б. Аммоний хлориді ерітіндісінің 0,1 М рН-ын есептейміз: NH қышқыл негіз
Аммоний иондары әлсіз қышқыл болғандықтан, мынаны болжауға болады [NH4+] = CNH4+ = 10-1 г-ион/л Бұдан: Сусыз этил спиртіндегі (
Демек:
Әлсіз негіз үшін (CB<10-4M, a<5%) ерітінді қышқылдығын есептеу (30) теңдеумен жүргізіледі:
Натрий ацетатының 0,1М ерітіндісінің рН-ын есептейміз. СН3СОО- + Н2О Û СН3СООН + ОН- негіз қышқыл
Диссоциация дәрежесі төмен әлсіз қышқылдың сұйытылған ерітінділері Сутек және гидроксил иондарымен қамтамасыз ететін еріткіш - судың диссоциациясын ескере отырып, әлсіз қышқылдың сұйытылған ерітіндісінің (СНА<10-4¸10-5) рН-ын есптеу үшін теңдеу шығарамыз. НА Û Н+ + А- [H+] = [A-] + [OH-] (33) H2O Û H+ + OH- KW = [H+][OH-]
(34) және (35) теңдеулерін (33) теңдеуге қоямыз:
Қаралып отырған категорияға жататын негіз үшін:
4-суретте көрсетілген қисықтардың талдауы мынаны көрсетеді: рН=8-ден бастап күшті қышқыл үшін ерітіндіні сұйылтуды ескере отырып рН есептегенде, күшті қышқыл концентрациясына тәуелсіз рН тұрақтылығы байқалады. рН=6 дейін ерітінді қышқылдығы қышқыл концентрациясымен анықталады, рН=6-дан рН=8 дейін ерітінді қышқылдығына қышқыл да, еріткіш те үлесін қосады, ал рН=8 кейін ерітінді қышқылдығы тек еріткіш - сумен анықталады. Әлсіз қышқыл үшін (<<-аминопропион немесе хлорлылау5%), мысалы, қышқыл үшін (4-сурет) еріткіш рН-тың төмен мәнінде әрекеттесуге түседі және КНА төмен болған сайын ертерек әрекеттеседі. Қатты сұйылтылған қышқылды ескермей қышқыл ерітіндісінің рН-ын жуық шамамен есептегенде, рН-gCHA тәуелділігі әлсіз және күшті қышқылдар үшін А және В нүктелерінде қиылысады. Ол, біз қарастырған қышқылдар үшін, осы нүктеден кейінгі концентрациялар үшін сутек ионының концентрациясын есептеуді қышқылдың жалпы концентрациясы бойынша жүргізуге болатынын көрсетеді, себебі: өте сұйылтылғанда әлсіз қышқылдың диссоциация константасының мәні жоққа жуық.
4-сурет. Қышқылдың электролиттік диссоциация константасы және концентрациясының ерітінді қышқылдығына әсері
Сонымен, СНА=10-7 (В нүктесінде) болғанда хлорлылау қышқылы (HСlO) үшін:
Дәрістер. Күші орта қышқылдардың өте сұйытылған ерітінділерінің қышқылдығын анықтайтын факторлар мен процесстер. Күші орташа қышқылдар (H3PO4, HF, H2C4H4O6, H3AsO4 және т.б.) ерітінділері рН-ын есептеу. Әлсіз қышқылдардың өте сұйытылған ерітінділері (СHnA ≤ 10-4 M) рН-ын есептеу. Күші орташа қышқылдар (негіздер) ерітінділері. Диссоциация дәрежесі 5-тен 30% дейін қышқылдар үшін (H3PO4, HF, H3AsO4, H2C4H4O6 және т.б.) [HA]дбаған шамамен қышқылдың жалпы концентрациясына тең деп болжауға болмайды. [HA]дбаған = СНА – [H+], сонда [H+] = [A-] болғанда (31) теңдеуден: [H+]2 + KHA[H+] – KHA.CHA = 0
Азотты қышқылдың 0,1М ерітіндісінің рН-ын есептейік. 30% шегінде болатын қышқылдарғаАзотты қышқылдың диссоциация дәрежесі 5 жататынына көз жеткіземіз:
Азотты қышқылдың 0,1М ерітіндісінің қышқылдылығын (32) теңдеу бойынша есептейміз:
Концентрациясы 10-4 М-нен жоғары және диссоциация дәрежесі 5%-дан жоғары негіздер ерітінділерінің рН-ын ұқсас формуламен есептейміз:
СО32- негіз диссоциациясының дәрежесін есептейміз:
СО32- негіздің 0,1 М ерітіндісінің қышқылдығын есептейміз:
рН = 11,90 Дәрістер. Әлсіз қышқылдар аниондарының мольдік мөлшерінің ерітінді рН-на тәуелді-лігінің протолиттік тепе-теңдігін талдау («α - рН» тәуелділігі диаграммасы).
Аналитикалық химияда қышқылдың, негіздің, амфолиттің және буферлік қоспалардың сулы ерітінділеріндегі рН мәнін бағалау өте маңызды. Толық бөлу және иондарды анық сапалық табу үшін талдаудың жүйелік әдісінде (S2-, CO32-, H2PO4- және т.б.) топтық реактив болып табылатын әлсіз қышқыл аниондарының мөлшерін есептей білу керек. Сулы ерітіндіде әлсіз қышқылдың түрлі формалары болуының айырмашылықтары арасындағы тепе-теңдікті графикалық көрсету ыңғайлы. Қышқылдың түрлі формаларының мольдік үлесі сулы ерітінді рН-на тәуелділік диаграммалары, үлестіру диаграммалары, артық мөлшерде болу аймақтар диаграммалары бар. Сулы ерітінді рН-на сірке қышқылы және ацетат иондардың болуының тәуелділігінің диаграммасын, үлестіру диаграмманы және артық мөлшерде болу аймақтар диаграммаларын тұрғызамыз және қарастырамыз: НА Û Н+ + А-
Ерітінді рН-на тәуелді сулы ерітіндідегі сірке қышқылының түрлі формаларының болуы бойынша есептік мәндер.
Бұл диаграмма бойынша рН»5 максималды буферлік сиымдылығында сірке қышқылы ерітіндісінде буферлік қоспа СН3СООН+СН3СОО- бар. Үлестіру диаграммалар қышқылдың әртүрлі формаларын мольдік үлеспен біртіндеп қосу арқылы алынады.
12-сурет. Сірке қышқылы және ацетат-иондардың үлестіру диаграммалары Артық мөлшерде болу аймақтар диаграммаларынан қышқылдың (негіздің) бір түрі көп мөлшерде болу рН аймағын көруге болады.
13-сурет. Сулы ерітіндідегі сірке қышқылы және ацетат-иондардың артық мөлшерде болу аймақтар диаграммасы
Сулы ерітіндідегі екінегізді қышқылдың түрлі формалары тәуелділік диаграммасын, үлестіру диаграмманы, түрлі формалардың артық мөлшерде болу аймақтар диаграммасын тұрғызамыз. H2S Û H+ + HS-
HS- Û H+ + S2-
Сулы ерітіндідегі күкіртсутек қышқылының әртүрлі формалары болуының рН-тан тәуелділік есептік мәні 11кесте
рН=0,5 жағдайында талдаудың күкіртсутектік жүйелік әдісінде топтық реактив болып табылатын сульфид-иондарының мольдік үлесін есептейміз:
Есептеулерден диаграммадан сияқты күшті қышқыл ортада сульфид-иондардың концентрациясы өте төмен және күкіртсутекпен мыс пен күшән топшасының қиын еритін сульфидтерін тұндыруға болатынын көруге болады. рН = 9 болғанда
Әлсіз сілті ортада сульфид-иондарының мөлшері 15 ретке жоғары және көрсетілген ортада ІІІ топтың ерігіш сульфидтерін тұндыру мүмкін. Диаграмма бойынша рН=7 болғанда буферлік сиымдылығы максимал буферлік қоспа S2- + HS- түзіледі, ол есептеу нәтижелеріне сәйкес.
Күкіртсутек қышқылдың түрлі формалары үшін үлестіру диаграммасын тұрғызамыз.
15-сурет. Күкіртсутек, гидросульфид иондар және сульфид-иондардың үлестіру диаграммасы
Артық мөлшерде болу аймақтар диаграммасы келесі түрде болады:
16-сурет. Сулы ерітіндідегі гидросульфид-иондардың және күкіртсутектің артық мөлшерде болу аймақтар диаграммасы
Үшнегізді фосфор қышқылы түрлі формаларының ерітінді рН-на тәуелді ерітіндіде болу диаграммасын тұрғызамыз: Н3РО4 Û Н+ +Н2РО42-
Н2РО4- Û Н+ + НРО42-
НРО42- Û Н+ + РО43-
рК1 = 2 рК2 = 7 рК3 = 12
рН-тан тәуелді фосфор қышқылы әртүрлі формалары болуының есептік мәндері
18-сурет. Фосфор қышқылы түрлі формаларының мольдік үлестер тәуелділігінің үлестіру диаграммасы
Бірінші диаграмма бойынша фосфор қышқылының ерітіндісінде үш буферлік қоспа болады: Бірінші Н3РО4 + Н2РО4- рН» 2 Екінші Н2РО4- + НРО42- рН» 7 Үшінші НРО42- + РО43- рН» 12
Дәріс. Қарапайым, қатарласқан гомогенді және гетерогенді аналитикалық реакциялар тепе-теңдігінің термодинамикасы.
Химияның басты заңы - әсер етуші массалар заңы талдаудың көптеген әдістерінің теориялық негізі болып табылады. Бұл заң қайтымды химиялық реакциядағы заттар арасындағы сандық қатынасты орнатады, ал аналитикалық реакциясының көпшілігі қайтымды. Мысалы, А + В Û С + D Сұйытылған ерітінділерде f = 1 және а = С тура реакция жылдамдығы: V1 = K1[A][B] (8) Мұнда K1 – тура реакция жылдамдығының константасы. Кері реакция жылдамдығы: V2 = K2[C][D] (9) Химиялық тепе – теңдік орнаған сәттегі қайтымды және қайтымсыз реакциялардың жылдамдығы: V1 = V2; K1[A][B] = K2[C][D]; Kт-т =
Бұдан күрделірек аналитикалық реакция үшін: аА + bВ Û cC + dD; Кт-т = Реакция өнімдерінің тепе – теңдік аналитикалық концентрация туындыларының бастапқы заттардың аналитикалық концентрация туындыларына қатынасы тепе – теңдік константасы болып табылады. әрекеттесуші заттардың сұйытылған ерітіндідегі қайтымды реакция тепе – теңдігінің константасы температура және қысым, сонымен қатар ерітіндінің иондық күшінің функциясы болып табылады және әсер етуші заттардың концентрациясына тәуелді емес. (11) және (12) теңдеулерде көрсетілген тепе – теңдік константалары – концентрациялық, себебі бұл теңдеулерге М-мен алынған реакция мүшелерінің тепе – теңдік концентрациялары кіреді. Концентрациялық константа тұрақтылығы – қысым, температура және иондық күштің тұрақтылығында орын алады. Соңғысына ерітіндіге индифференттік электролиттің көп мөлшерін енгізу арқылы қол жеткіземіз. Сонда ерітіндінің иондық күші іс жүзінде тек енгізілген электролитпен анықталады және белгіленген тұрақты мәнге ие. Тепе-теңдік константасы үшін теңдеуді тек термодинамикалық жолмен табуға болады, мұнда кинетикалық заңдар белгілі ме, жоқ па бәрібір, яғни химиялық реакцияларға қатысушылардың жылдамдығы мен концентрациясының арасындағы байланыс. Реалды ерітінділерде аналитикалық реакциялар әдетте тұрақты қысымды және температурада жүретіні жақсы мәлім. Мұндай шарттарда қарастырылатын кез-келген жүйенің, мысалы ерітіндінің жағдайын Гиббстің (G) бос энергиясын қолданып, термодинамикалық көрсетуге болады. Реалды ерітінділерде еріген заттардың бос Гиббс энергиясы берілген заттың белгілі жағдайдағы белсенділігімен байланысты, ол келесі теңдеу: G = RTlna (13) Осы заттың стандартты күйдегі (G°) Гиббстің бос энергиясы былай болады: G0 = RTlna0 (14) Зат стандарттан берілген жағдайға көшкенде бос энергия мөлшерге өзгереді: G – G0 = RTlna – RTlna0 = RTln Бұдан, Гиббстің бос энергиясы осы жағдайда: G = G0 + RTln мұнда Шығарылған (16) теңдеуден көретініміз, заттың Гиббс бос энергиясы стандартты жағдайда таңдауға тәуелді. Көбіне стандартты жағдай деп таза зат таңдалынады, қолданылатын математикалық теңдікті қарапайымдау үшін а0 = 1 Сонда: G = G0 + RTlna (17) А және В екі заттың арасындағы химиялық реакцияны қарастырамыз: Z1A + Z2B = Z1'C + Z2'D Заттар арасындағы әрекеттесу химиялық тепе – теңдік орнағанға дейін жүреді. Реакцияның термодинамикалық химиялық тепе – теңдіктері былай көрсетіледі, реакция өнімінің бос Гиббс энергиясының сомасы – қалған әсерлеспеген бастапқы заттардың бос Гиббс энергиясының сомасына тең болады: Z1GA + Z2GB = Z1'GC + Z2'GD Z1(GA0 + RTlnaA) + Z2(GB0 + RTlnaB) = Z1'(GC0 + RTlnaC) + Z2'(GD0 + RTlnaD) (18) (18) теңдеуге кейбір өзгерістер енгіземіз: (Z1GA0 + Z2GB0) – (Z1'GC0 + Z2'GD0) = RT(Z1'lnaС + Z2'lnaD) - RT(Z1lnaА + Z2lnaВ) (19) Бұдан: (20) теңдеудің екі бөлігін де RT-ға бөлеміз:
(21) теңдеуде логарифмнен босаймыз. Сонда:
Температура мен қысымның тұрақты мәндерінде
(23) теңдеуден көрінгендей, реакцияның химиялық тепе – теңдік константасын былай анықтауға болады: реакцияның өнімдерінің тепе – теңдік константасы тәжірибеде анықталған мәндерімен және әсерлеспеген бастапқы химиялық заттар мәндерімен немесе реакция мүшелерінің стандартты молярлы бос энергиялар шамалары бойынша.
Тотығу-тотықсыздану процестері – валенттік күйі өзгере отырып жүретін қайтымды процесс, яғни электрон бере отырып жүретін процесс. Тотықтырғыштан тотықсыздандырғышқа электрон ауысқанда жұмыс жасалады: A = nF(φ2 - φ1), (1) мұнда n – процеске қатысатын электрондар саны; F – Фарадей тұрақтылығы, 96500 Кл.; φ2 - φ1 – формалар арасындағы потенциалдар айырмашылығы. Химиялық реакциялар тұрақты температура және қысымда жүреді, сондықтан электрондар тасымалдау жұмысын Гиббстің (G) бос энергиясы көмегімен сипаттау керек: A = ΔG = GOx - GRed Реалды ерітінділерде Гиббс бос энергиясы заттың белсенділігімен байланысты, яғни
Онда жұмыс келесідей сипатталады:
немесе
(2) теңдеуін (1) теңдеуді ескере отырып келесідей жазамыз:
φ2 - φ1 айырмашылығын іс жүзінде анықтау мүмкін емес. Берілген және басқа тотығу-тотықсыздану жұптарының арасындағы потенциалдар айырмашылығын – екі редоксжұп ерітіндісіне батырылған екі электродтан гальваникалық элементті жинап анықтайды. Екінші редоксжұп – көбіне стандартты 2Н+/Н2 жұп, оның потенциалы есептеудің нольдік нүктесі деп қабылдаған. Стандартты сутекті электрод – сутекпен адсорбцияланған платина қарасы жағылған, тұз (немесе күкірт) қышқылы
Тұрақты мәндерді біріктіреміз:
Бұдан:
мұнда Гетерогенді тепе-теңдік. Қиын еритін қосылыстар – тұнбалардың түзілу реакциясы аналитикалық химияда сапалық талдауда иондарды анықтау мен бөлу үшін және сандық талдауда гравиметрлік және титриметрлік тұндыру анықтаулары үшін кең қолданылады. Тұнба түзілгеннен кейін тұнба мен қаныққан ерітінді арасында жылжымалы гетерогенді тепе-теңдік орнайды: AgI ↔ Ag+ + I- тұнба қаныққан еріт-лер Тепе-теңдік жағдайында тұнба мен қаныққан ерітінді арасында процестер тура және кері бағытта жүреді, олардың жылдамдықтары тең. Күміс иондарының тұнбадан ерітіндіге өту жылдамдығы олардың концентрациясына және иондардан бос емес тұнба бетіне тура пропорционал:
Тұнба иондарының қатысында кері реакция жылдамдығы ұқсас:
Сонымен, тура реакция жылдамдығы: Кері реакция жылдамдығы: Олардың тепе-теңдігінде:
Барлық тұрақты шамаларды бір жаққа шығарамыз:
Теңдеудің сол жағындағы тұрақты шаманы ЕКAgI арқылы белгілейміз, сонда:
Ерігіштік көбейтіндісі үшін теңдеуді тұнба/қаныққан ерітінді жүйесіндегі тепе-теңдік жағдайы нүктесінен қарастыруға болады. Тұнбалар суда аз ериді, сондықтан тұнба үстіндегі қаныққан ерітінді идеалды жүйеге жақын сұйытылған ерітінді болып табылады. Одан басқа, тұнба молекулаларының түзілу процесі қайтымды. Сондықтан гетерогенді тепе-теңдікті тепе-теңдік константасымен сипаттауға болады:
Кез-келген химиялық реакция тұрақты қысым мен температурада жүреді, сондықтан термодинамикалық қатынаста тұнба мен қаныққан ерітінді арасындағы гетерогенді тепе-теңдікті Гиббстің бос молярлы энергиясы арқылы қарастыру керек. Жалпы түрде келесі гетерогенді тепе-теңдік бар дерлік: AmBn Û mA + nB тұнба қанық еріт-лер тұнба/қаныққан ерітінді жүйесінің динамикалық химиялық тепе-теңдік жағдайында қатты фазаның Гиббс энергиясы қиын еритін қосылыс иондарының Гиббс энергиясының қосындысына тең, яғни:
Қатты фаза мен қиын еритін қосылыс иондарының Гиббс бос энергиялары стандартты бос энергия және белсенділікпен анықталады:
Бұдан:
Гиббстің стандартты энергияларын сол жаққа ауыстырамыз:
Сол жақтың тұрақты шамаларын Z∆G0 арқылы белгілейміз, сонда:
Сол жақтың тұрақты шамаларын ерігіштіктің көбейтіндісімен белгілейміз:
Берілген теңдеу ерігіштіктің термодинамикалық көбейтіндісін жалпы түрде сипаттайды. Иондардың белсенділігін олардың концентрациясының белсенділік коэффициентіне көбейтіндісімен анықталатынын ескерсек, ерігіштік көбейтіндісін былай көрсетуге болады:
Дәрістер. Қышқыл (негіз) күшінің ерітіндінің компонентті құрамына тәуелділігін бейнелейтін қос протолиттік тепе-теңдіктің негізгі теңдеуі.
Бренстед теңдеуі еріткіш табиғатының қышқыл күшіне әсерін толығырақ көрсетеді. Оны шығарамыз: гипотетикалық еріткіштердегі қышқылдық – негіздік тепе – теңдік компоненттерінің белсенділігін былай белгілейміз: аНА; аS, aHS+; aA- Гипотетикалық еріткіш – ол өте үлкен диэлектрлік өткізгіштікке ие ерітуші орта. Осы ортадағы ол компоненттің белсенділігін былай белгілейміз: а*НА; а*S, a*HS+; a*A- Берілген ортадағы протолитикалық тепе – теңдіктің термодинамикалық сомалық константасы мынаған тең:
Гипотетикалық еріткіштерде мынадай тепе – теңдіктер бар: HA Û H+ + A- HS+ Û H+ + S
Гипотетикалық және берілген еріткіштердің компоненттерінің белсенділігінің арасында математикалық байланыс бар: а = f a*, (2) мұнда f – белсенділік коэффициенті 1-ге тең, шексіз үлкен диэлектрлік өткізгіштігі бар (Д = ¥) гипотетикалық еріткішке қатысты, заттың берілген еріткіште шексіз сұйылтылған белсенділік коэффициенті. Онда тепе – теңдіктің термодинамикалық константасын (2) теңдеуді ескере отырып былай жазуға болады:
немесе
мұнда (5) теңдеуді (4) теңдеуге қойсақ:
ZA-= ZHA – 1; ZS = ZHS+– 1; сонда ZA-2= (ZHA – 1)2 = ZHA2– 2ZHA + 1 (7) ZS2 = (ZHS+ - 1)2 = ZHS+2– 2Z Дата добавления: 2015-10-18; просмотров: 1017. Нарушение авторских прав; Мы поможем в написании вашей работы! Понятие метода в психологии. Классификация методов психологии и их характеристика Метод – это путь, способ познания, посредством которого познается предмет науки (С...
Расчет концентрации титрованных растворов с помощью поправочного коэффициента При выполнении серийных анализов ГОСТ или ведомственная инструкция обычно предусматривают применение раствора заданной концентрации или заданного титра...
|

 (28)
(28)

 . Бұдан
. Бұдан ; рН = 1/2(рКНА + рСНА) (29)
; рН = 1/2(рКНА + рСНА) (29) + H2O Û H3O+ + NH3
+ H2O Û H3O+ + NH3
 ; рН = 5,13.
; рН = 5,13. ) 0,001М құмырсқа қышқылы ерітіндісінің рН есептейміз:
) 0,001М құмырсқа қышқылы ерітіндісінің рН есептейміз:
 ; рН = 6,08.
; рН = 6,08. (30)
(30)
 ; рН = 8,88.
; рН = 8,88.
 (34), [HA]нд»СНА және [H+]¹[A-] болғанда
(34), [HA]нд»СНА және [H+]¹[A-] болғанда  (35)
(35) ; [HA+]2 = KHA . CHA + KW ;
; [HA+]2 = KHA . CHA + KW ;  (36)
(36)



 - қышқылды сұйылта отырып есептелген рН--lgСНА тәуелділігінің қисығы;
- қышқылды сұйылта отырып есептелген рН--lgСНА тәуелділігінің қисығы; - қышқылдың сұйылтуын ескермей есептелген рН--lgCНА тәуелділігінің қисығы;
- қышқылдың сұйылтуын ескермей есептелген рН--lgCНА тәуелділігінің қисығы; - a- аминопропион қышқылы үшін (КНА = 7.10-10);
- a- аминопропион қышқылы үшін (КНА = 7.10-10); -хлорлылау қышқылы үшін (КНА = 2,95.10-8);
-хлорлылау қышқылы үшін (КНА = 2,95.10-8); - күшті бір негізді қышқыл үшін.
- күшті бір негізді қышқыл үшін. 7рН. Қышқылдың мұндай концентрациясында ерітіндінің рН-ын келесі жолмен есептеуге болады: [H+] = CHClO4= 10-7 рН = 7.
7рН. Қышқылдың мұндай концентрациясында ерітіндінің рН-ын келесі жолмен есептеуге болады: [H+] = CHClO4= 10-7 рН = 7.
 (31)
(31) (32)
(32)
 рН = 2,06
рН = 2,06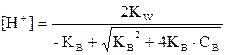 (33)
(33)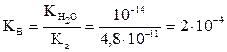 ;
; 

 ;
;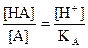












 ;
; 

 ;
; 



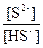




 [H2S] = [HS-] болғандықтан, [H+] = K1; pH = pK1
[H2S] = [HS-] болғандықтан, [H+] = K1; pH = pK1













 ;
; 
 ;
; ;
; 
 ;
;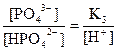 ;
; 




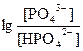






















 (10)
(10) (11)
(11) (15)
(15) (20)
(20) (21)
(21) (22)
(22) шамасы тұрақты шама болып табылады. Сонымен, белсенділіктер қатынасы да тұрақты шама. Сондықтан бұл қатынасты реакцияның химиялық тепе – теңдігінің константасы деп аталады:
шамасы тұрақты шама болып табылады. Сонымен, белсенділіктер қатынасы да тұрақты шама. Сондықтан бұл қатынасты реакцияның химиялық тепе – теңдігінің константасы деп аталады: (23)
(23)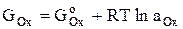 ;
; 

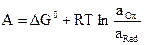 (2)
(2) ;
; 
 ерітіндісіне батырылған платиналық электрод. Қысым 1 атм. болғанда электрод сутекпен қанығады. Оның потенциалы 0-ге тең. Сонда:
ерітіндісіне батырылған платиналық электрод. Қысым 1 атм. болғанда электрод сутекпен қанығады. Оның потенциалы 0-ге тең. Сонда:


 ,
, - жарты реакцияның стандартты электродтық потенциалы.
- жарты реакцияның стандартты электродтық потенциалы. (1);
(1);  (2).
(2). (3);
(3);  (4).
(4). (5).
(5). (6)
(6)
 (7);
(7);  (8).
(8). (9)
(9) (10)
(10) (11);
(11); 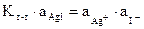 ;
;  (13)
(13) (14)
(14) (15);
(15);  (16).
(16). (17)
(17) (18)
(18) (19)
(19) (20);
(20);  (21).
(21). (22)
(22)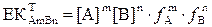 (23)
(23)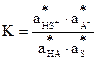


 (1)
(1) (3)
(3) ;
; (4)
(4) екені белгілі (5)
екені белгілі (5) - электро заряды; N – Авогадро саны; Z – бөлшек заряды; R – газ тұрақтылығы; Т – абсолюттік температура; D – ортаның диэлектрлік өткізгіштігі; r – бөлшек радиусы.
- электро заряды; N – Авогадро саны; Z – бөлшек заряды; R – газ тұрақтылығы; Т – абсолюттік температура; D – ортаның диэлектрлік өткізгіштігі; r – бөлшек радиусы. (6)
(6)


