Дәрістер. Жанама протондану және гидролиз-дену реакцияларының гетерогенді тепе-теңдік жағдайындағы тұнба ерігіштігіне әсері.
Сулы ерітіндіде қиын еритін қосылыстардың аниондары мен катиондары еріткішпен әрекеттесіп протондалуы мүмкін, ол тұнба ерігіштігіне елеулі әсер етеді. Қаныққан ерітіндімен тепе-тең никель сульфидінің тұнбасын алайық: NiS Û Ni2+ + S2- тұнба қанық еріт. Никель иондары сулы ерітінділерде гидролизденеді: Ni2+ + HOH Û NiOH+ + H+
Бұдан, никельдің гидролизденген формасының концентрациясы мынаған тең:
Никель иондары ерітіндіде түрлі формада болатындықтан, материалдық баланс теңдеуін құрастырамыз: СNi = [Ni2+] + [NiOH+] (34) Бұл теңдеуге никельдің гидролизденген формасы концентрациясының мәнін қоямыз және никель иондарының тепе-теңдік концентрациясын анықтаймыз:
Сулы ерітінділерде сульфид-иондар да гидролизге ұшырайды: S2- + H+ Û HS- HS- + H+ Û H2S Онда тұнба үстіндегі қаныққан ерітіндіде түрлі күкіртті формалар болады:
Бұдан, сульфид-иондардың тепе-теңдік концентрациясы:
Әрине, никельдің түрлі иондарының жалпы концентрациясы күкіртті формалардың және никель сульфидінің ерігіштігінің жалпы концентрациясына тең:
Никель сульфидінің иондары қатысының мәндерін ерігіштік көбейтіндісі теңдеуіне қоямыз:
Шығарылған теңдеу бойынша бейтарап ортада никель сульфидінің ерігіштігін анықтаймыз: рН =7, ЕКNiS = 10-24, Kr = 5·10-8,
Гидролиз процесін және оған тұнба иондарының қатысын ескермесек, онда: SNiS =[Ni2+]=[S2-]= Яғни, никель сульфидінің есептелген ерігіштгі 1600 есе көп:
|

 (32)
(32)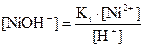 (33)
(33) (35)
(35)
 (36)
(36)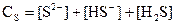 (37)
(37) (38)
(38)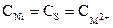 , (39)
, (39) (40)
(40)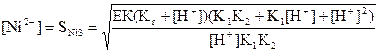 (41)
(41) ,
, 
 =1,6·10-9 M
=1,6·10-9 M =
= 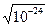 =10-12 M
=10-12 M



