Дәрістер. Көпсатылы комплекстүзілу тепе-теңдігін графиктік түрде бейнелеу және талдау
Сатылы комплекстүзуді зерттеудің кең тараған әдістерінің бірі Бьерум әдісі. Н. Бьерум комплекс түзілу функциясын (
мұнда СL – лигандтың жалпы концентрациясы; [L] –бос лиганд иондарының тепе-теңдік концентрациясы; СМ –металл иондарының жалпы концентрациясы. Түзілу функциясы комплекстегі бір металл ионына тиісті лигандтардың орта санын көрсетеді. Құрамы MLn комплекс түзілді дерлік, ол сатылы диссоциацияланады, яғни ерітіндіде комплексті қосылыстардың бірнеше түрлері болады. Металл және лиганд үшін материалдық баланс теңдеуін құрастырайық: CM = [M] + [ML] + [ML2] +..... +[MLn] = [M] + CL = [L] + [ML] + 2[ML2] +..... + n[MLn] = [L] + Комплекстердің тұрақтылық константалары бойынша оның әр түрлерінің концентрациясын анықтайық: 1. M + L Û ML 2. ML + L Û ML2 ............ ............ n. MLn-1 + L Û MLn Комплексті қосылыстардың концентрациясын материалдық баланстың (1) және (2) теңдеуіне қояйық:
Сонда комплекс түзілу функциясы:
Түзілу функциясы 0-ден N-ге дейін өзгере алады. Егер лигандтың жалпы концентрациясы оның тепе-теңдік концентрациясына тең болса, онда Еі алтылигандты коплекстің түзілу қисықтарын есептейік:
Комплекс түзілу функциясының лиганд концентрациясы көрсеткішінен тәуелділігі бойынша есептеу мәліметтері 13-кесте
22-сурет. Комплекс түзілу қисықтары 1 – сынап (II)-нің цианид-ионымен комплекс түзу қисығы; 2 – кобальт (II)-нің аммиакпен комплекс түзу қисығы.
(1) қисықты талдаудан цианид иондары концентрациясы 10-4-тен 10-15 М-ге дейінгі мәнінде комплекс түзілу жүрмейтінін көруге болады, бұл аймақта ерітіндіде тек HgCN2 молекулалары болады. (2) қисықты талдау бойынша концентрациясы 10-1-ден 1 М-ге дейін ерітіндіде координациялық саны 6-ға тең құрамы [Co(NH3)6]3+ комплекс басым болады. Концентрация мәні 10-3-тен 10-2 М дейін түзілу функция бөлшек сан, ол ерітіндіде координациялық саны 6 және 5-ке тең [Co(NH3)5]3+ және [Co(NH3)6]3+ бар екенін дәлелдейді. Бьерум әдісі бойынша комплекс түзілу қисығын мына жолмен тұрғызады. Металдар иондарының концентрациясы тұрақты, ал лиганд концентрациясы әр түрлі бірқатар ерітінділер дайындалады. Әр ерітіндідегі лигандтың тепе-теңдік концентрациясы анықталып, сәйкес есептеулер жасалғаннан кейін Еріткіш қышқылдығы комплекс түзілуге екі түрлі әсер етеді: не комплекс түзуші иондар (металл) гидроксил иондарымен гидроксокомплекстер түзеді, не бос лигандтар протондарды қосып алады. Гидроксокомплекс түзілу функциясы едәуір мөлшерде сулы ерітіндінің қышқылдығына тәуелді. Бұл жағдайда алюминий гидроксокомплекстерінің түзілу функциясының гидроксил иондарының (рОН) концентрация көрсеткішінен тәуелділігі арқылы көруге болады (23-сурет). Ерітіндіде ерітіндінің қышқылдығына байланысты алюминий гидроксокомплекстерінің қышқылдығына байланысты алюминий гидроксокомплекстерінің төрт түрін түзе алады: [Al(OH)]2+ [Al(OH)2]+ [Al(OH)3] [Al(OH)4]-
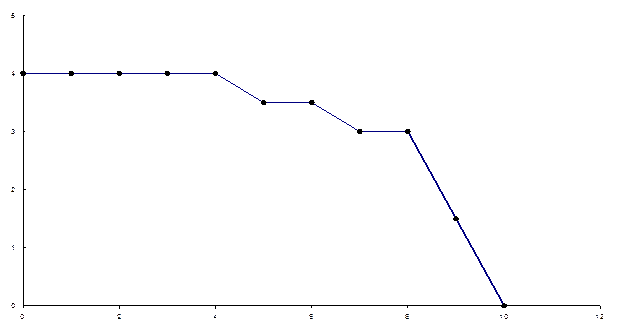
23-сурет. Алюминий гидроксокомплекстері түзілу қисығы
рOН аймағының 4-ке дейінгі мәнінде ең тұрақты [Al(OH)4]- гидрокомплексі басым болады, кейін қышқылдық төмендеген сайын комплекс түзілу қисығында түзілу функциясы бөлшек санға ие аймақ байқалады, ол ерітіндіде екі [Al(OH)4]- және Al(OH)3 гидроксокомплекстерінің болуын дәлелдейді. рОН мәні 7-8 аймақта алюминий гидрототығы түзілуі байқалады. Іс жүзінде алюминий гидрототығының ерігіштік көбейтіндісінен оның түзілу рОН=8-де болуы тиіс.
|

 ) енгізген. Комплекс түзілу функциясы ол – металл ионы мен комплекске байланысқан лиганд концентрациясының жалпы металл иондарының концентрациясына қатынасы:
) енгізген. Комплекс түзілу функциясы ол – металл ионы мен комплекске байланысқан лиганд концентрациясының жалпы металл иондарының концентрациясына қатынасы: ,
, (1)
(1)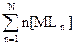 (2)
(2) ; [ML] = b1[M][L]
; [ML] = b1[M][L] ; [ML2] = b1b2[M][L]2
; [ML2] = b1b2[M][L]2 ; [MLn] = bn[M][Ln-1] = bn[M][L]n
; [MLn] = bn[M][Ln-1] = bn[M][L]n







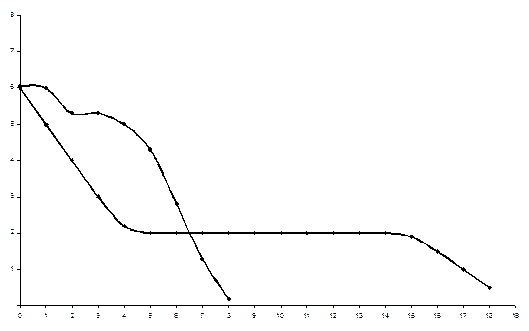
 1 = 109
1 = 109
 ; рОН = 8,4
; рОН = 8,4


