Дәрістер. Жанама комплекстүзілу реакциясының гетерогенді тепе-теңдік жағда-йындағы тұнба ерігіштігіне әсері.
Қиын еритін қосылыстар иондары көп сатылы комплекс түзілуге қатыса алады. Лиганд сандары әртүрлі комплекстер түзілуін суда тұнбаның ерігіштігін есептеу кезінде ескеру қажет. Артық хлорид-иондары болғандағы күміс комплекс түзілу шартында және комплекс түзілу жоқ болған шартында күміс хлоридінің ерігіштігін есептейік. Гетерогенді тепе-теңдік теңдеуін жазамыз: AgCl Û Ag+ + Cl- тұнба қанық. еріт. Күміс иондарының көпсатылы комплекс түзілуді суреттеп көрсетеміз: Ag+ + Cl- = AgCl [AgCl] = β1[Ag+][Cl-] β1 = 2,04·103 AgCl + Cl- = [AgCl2]- [AgCl2]- = β1 β2[Ag+][Cl-]2 β2 =1,76·105 [AgCl2]- +Cl- =[AgCl3]2- [AgCl3]2- = β1β2β3[Ag+][Cl-]3 β3 = 4·106 [AgCl3]2- + Cl- =[AgCl4]3- [AgCl4]3- = β1β2β3β4 [Ag+][Cl-]4 β4 = 1,2·106
Онда күміс иондарының тепе-теңдік концентрациясы:
Басқа жағынан, күміс иондарының тепе-теңдік концентрациясы тұнба үстіндегі қаныққан ерітіндіде мынаған тең:
ЕКAgCl=1,78·10-10 болғанда және комплекс түзілу болатын хлорид-иондардың концентрациясында ерітіндідегі күміс иондарының құрамы 2,9М тең. Күміс иондарының тепе-теңдік концентрация теңдеулерін қолданып, былай жазуға болады:
Осыдан, күміс хлоридінің ерігіштігі:
Комплекс түзілудің жанама реакциясы жоқ кездегі күміс хлоридінің ерігіштігін есептейміз:
Натрий хлоридінің 0,004 М концентрациясында ерітіндінің иондық күші мынаған тең:
Күміс иондары мен хлор-иондардың белсенділік коэффициентін есептейміз:
f ± = 0,92
Күміс хлориді ерігіштігінің концентрациялық көбейтіндісінің мәнін анықтаймыз:
Комплекс түзілу жоқ болған жағдайдағы күміс хлоридінің ерігіштігін анықтаймыз:
Суда қиын еритін күміс хлориді катионының комплекс түзудің жанама реакциясы жүргенде тұздың еруі 8 есе көбейеді. Мынадай жағдайлар мүмкін, қиын еритін электролиттің катионы комплекс түзілуге ұшырайды, ал оның анионы протондалады. МеХ құрамды тұнба бар деп есептейік:
MeХ Û Ме2+ + Х2- тұнба қанық еріт. Тұнба катионы сәйкес құрамды комплекс түзе отырып анионмен әрекеттеседі: Х2- + 2А2- Û [MeA2]2- + X2-
Бұл теңдеуді металл ионының концентрациясына көбейтеміз және бөлеміз:
Тұнба үстіндегі қаныққан ерітіндідегі комплекс концентрациясын анықтаймыз: МеА22- Û МеА + А2- МеА Û Ме2+ + А2-
Металл иондарының жалпы концентрациясы үшін материалдық баланс теңдеуін құрамыз:
Металл иондарының тепе-теңдік концентрациясын және [MeA] комплексінің концентрациясын анықтаймыз:
Бұдан:
Басқа жағынан, тұнба анионы протондалады: Х2- + Н2О Û НХ + ОН- НХ + Н2О Û Н2Х + ОН- Қаныққан ерітіндіде тұнба аниондарының тепе-теңдік концентрациясын анықтаймыз:
(53) және (54) теңдеулерін (46) теңдеуіне қоямыз:
(47) теңдеуін ескереміз:
Сонда:
Бұл теңдеуді қарапайымдауға болады. Егер А2- күшті қышқылдың анионы болса, гидролизге түспесе және негізгі бір комплекс [MeA2]2- түзілсе, онда Сонда:
|

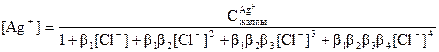 (42)
(42)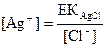 (43)
(43) (44)
(44) (45)
(45)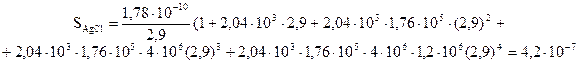

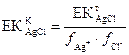
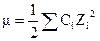


 = -0,0362
= -0,0362



 (46)
(46)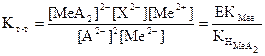 (47)
(47)
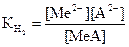
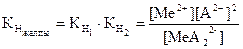
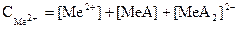 (48)
(48)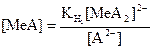 (49)
(49)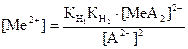 (50)
(50)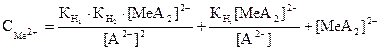 (51)
(51) (52)
(52) (53)
(53) (54)
(54)


 (55)
(55) болады
болады (56)
(56) және
және  мүшелерін ескермесе болады.
мүшелерін ескермесе болады. (57)
(57)


