Дәрістер. Жанама протондану реакциясының реалды ерітінділердегі негізгі аналитикалық реакциялардың жылдамдығына әсері.
Тепе – теңдік константасына реакцияға қатысушылардың М-мен көрсетілген концентрациясы болады, сондықтан концентрациялық деп аталады. Егер тепе – теңдіктің термодинамикалық константасы және химиялық тепе – теңдіктің қатысушыларының белсенділік коэффициенттері белгілі болса, тепе – теңдіктің концентрациялық константасын есептеп шығаруға болады. Мұның мәні КТ және КК арасында өзара байланысының болуында:
Реалды ерітінділерде негізгі химиялық реакциялармен қатар бөтен (сирек өзіндік) иондары қатысында бәсекелесуші жанама реакциялар жүруі мүмкін: Z1A + Z2 ZB 1'K + Z2'D Нәтижесінде, бәсекелесуші реакцияға кірісетін негізгі реакцияның компоненті ерітіндіде әртүрлі пішінде болады. Берілген компоненттің барлық теңсалмақты формаларының сомалық концентрациясы жалпы аналитикалық концентрация (С) деп аталады. Айқындысы: [A] = ACA, мұнда A – негізгі реакция А компоненті бойынша бәсекелесуші реакцияның коэффициенті. Компоненттердің жалпы концентрациясы арқылы көрсетілген тепе – теңдік константасы шартты деп аталады және Кш деп белгіленеді.
Тепе – теңдіктің шартты константасы температура қысымға, ерітіндінің иондық күшіне, бәсекелесуші реакция шақыратын заттардың концентрациясына және түзілетін қосылыстар табиғатына тәуелді.
Комплекстүзу процесі компоненттерінің бірімен әрекеттесуге қабілетті бөтен иондар (мысалы, сутек иондары, тұндырғыш иондар) ерітіндіде бар болса, онда есептеу және болжау кезінде тұрақтылықтың шартты константасын пайдалану керек.
мұнда C[Ag(NH3)2]+, CAg+, CNH3– комплекстүзу процесіне қатысушылардың жалпы концентрациялары. Процесс компоненттерінің тепе-теңдік концентрациялары тең: [Ag+] = CAg+.aAg+; [NH3] = CNH3.aNH3; мұнда aAg+ – күміс ионы қатысында мүмкін жанама реакция коэффициенті, aNH3– NH3қатысуымен мүмкін жанама реакция коэффициенті. [Ag(NH3)2]+ комплекстүзу өнімдері үшін жалпы концентрациясы оның тепе-тең концентрациясына тең. Сонда:
Күміс иондары жанама реакцияға түспейді, сондықтан:
немесе Лиганд -NH3 протонизациялану жанама реакциясына қатысады, яғни: NH3 + H2O Û NH4+ + OH- және ерітіндіде NH3 лиганд молекуласынан басқа NH4+ иондары болады. Материалдық баланс теңдеуін қарастырайық: С = [NH3] + [NH4+] Аммоний иондарының концентрациясын лиганд концентрациясы арқылы шығарайық: NH4+ Û NH3 + H+, сонда:
Лиганд үшін жанама реакцияның коэффициенті a лигандтың жалпы концентрациясынан протондалмаған лиганд концентрациясының үлесін көрсетеді. рН = 3 мәніндегі aNH3анықтайық.
Осыдан комплекстің шартты тұрақтылық константасының мәні:
Есептеулер бойынша күмістің аммиакты комплексінің тұрақтылық константасы өте аз шама, қышқыл ортада комплекстің түзілуі лигандтың едәуір протондалуынан мүмкін емес. рН=9 мәніндегі әлсіз сілті ортада шартты тұрақтылық константасының мәнін есептейік:
Сілті ортада комплекстің шартты тұрақтылық мәні жоғары, яғни рН = 9 күміс комплексі түзіледі. Комплекс неғұрлым тұрақты болса, соғұрлым лигандтың жанама протондалу реакциясы әлсіз жүреді. Мысалы: Ag+ + 2 CN- Û [Ag(CN)2]-
рН = 3 мәнінде b ш = bК. a
b ш = 1021. (5.10-3)2 = 2,5.1016 Титрлеу қисықтарын есептегенде жанама реакция жүруін ескере отыру керек. а. этилендиаминтетрасірке қышқылы анионының протондалуын ескермей кальций ионының комплексонометрлік титрлеу қисығын есептеп тұрғызайық. 1. 10 мл 0,1 М CaCl2 [Ca2+] = CCaCl2= 10-1 pCa1 = 1 2. 10 мл 0,1 М CaCl2 + 5 мл 0,1 М ЭДТА (Н4Y) Титрлеудің бұл нүктесінде ерітіндіде [CaY]2-, Ca2+титрленбеген. [CaY]2- Û Ca2+ + Н4- болады. Кальций иондарының көп мөлшерде болуы комплексонаттың диссоциациясын тежейді, сондықтан есептегенде кальций иондарының бос титрленбеген бөлігін ескеру қажет. [Ca2+] = CCaCl2т-беген = 3. 10 мл 0,1 М CaCl2 + 9 мл 0,1 М ЭДТА рСа3 = 2,3 4. 10 мл 0,1 М CaCl2 + 9,9 мл 0,1 М ЭДТА рСа4 = 3,3 5. 10 мл 0,1 М CaCl2 + 9,99 мл 0,1 М ЭДТА рСа5 = 4,3 6. 10 мл 0,1 М CaCl2 + 10 мл 0,1 М ЭДТА Титрлеудің бұл нүктесінде тек кальций комплексонаттары болады. Сондықтан [Ca2+] + [Y4-] = [CaY]2- При [CaY]2-дбаған» [CaY]2-жалпы = [Ca2+] = [Y4-]; bK = 5.1010
7. 10 мл 0,1 М CaCl2 + 10,1 мл 0,1 М ЭДТА Ерітіндіде кальций комплексонаттары және комплексонат диссоциациясын тежейтін ЭДТА аниондарының артық мөлшері болады. Сондықтан, титрант анионының мөлшері тек ЭДТА-ның артығымен анықталады. [Y4-] =
8. 10 мл 0,1 М CaCl2 + 11 мл 0,1 М ЭДТА рСа8 = 9,7 9. 10 мл 0,1 М CaCl2 + 13 мл 0,1 М ЭДТА рСа9 = 10,2 10. 10 мл 0,1 М CaCl2 + 15 мл 0,1 М ЭДТА рСа10 = 10,4
б) рН=10 мәніндегі Са2+ комплексонометрлік титрлеуінің қисығын ЭДТА (трилон Б) анионының протондалуын ескере отырып есептеу. 1. 10 мл 0,1 М CaCl2 pCa1 = 1 2. 10 мл 0,1 М CaCl2 + 5 мл 0,1 М ЭДТА рСа2 = 1,5 3. 10 мл 0,1 М CaCl2 + 9 мл 0,1 М ЭДТА рСа3 = 2,3 4. 10 мл 0,1 М CaCl2 + 9,9 мл 0,1 М ЭДТА рСа4 = 3,3 5. 10 мл 0,1 М CaCl2 + 9,99 мл 0,1 М ЭДТА рСа5 = 4,3 6. 10 мл 0,1 М CaCl2 + 10 мл 0,1 М ЭДТА ер-ді: [CaY]2-, [CaJnd]2- қызыл. Ерітіндідегі кальций иондарының негізгі көзі кальций комплексонаты болып табылады: [CaY]2- Û Ca2+ + Y4- Ерітіндідегі кальций иондары мөлшерін анықтауды комплексонаттың шартты тұрақтылық константасы бойынша жүргізеді, себебі комплексон анионы жанама реакцияда протондалуы мүмкін: Y4- + 2H+ Û [H2Y]2- Комплексонаттың диссоциацияланбаған бөлігінің концентрациясын анықтайық: [CaY]2-дбаған = [CaY]2-жалпы – [CaY]2-дис-ған» [CaY]2-жалпы [CaY]2-жалпы = Шартты тұрақтылық константасын есептейік: bш = b К. aY4- Жанама протондалу реакциясының коэффициентін анықтау:
Сонда bш = b К. aY4- = 5.1010. 0,5 = 2,5.1010 Анықталған комплексонаттың диссоциацияланбаған бөлігі мәнін және шартты тұрақтылық константасының мәнін (1) теңдеуге қояйық:
7. 10 мл 0,1 М CaCl2 + 10,1 мл 0,1 М ЭДТА р-р: [CaY]2-, [H2Y]2- артық
мұнда [Ca2+]=[Y4-] шарты орындалмайды, себебі титранттың артық мөлшері енгізілген. [Y4-] = [Y4-]артық [Y4-][CaY]2-» [Y4-]артық
Табылған мәндерді тұрақтылықтың шартты константасы теңдеуіне қоямыз:
8. 10 мл 0,1 М CaCl2 + 11 мл 0,1 М ЭДТА р-р: [CaY2-], [H2Y]2- рСа8 = 9 артық 9. 10 мл 0,1 М CaCl2 + 13 мл 0,1 М ЭДТА рСа9 = 9,8 10. 10 мл 0,1 М CaCl2 + 15 мл 0,1 М ЭДТА рСа10 = 10,0 Титрлеу қисығының секіруіне жанама реакцияның әсері ерітіндінің рН-на тәуелді, егер титрант анионы (мысалы, комплексонометрлік титрлеуде) протондалуға ұшыраса.
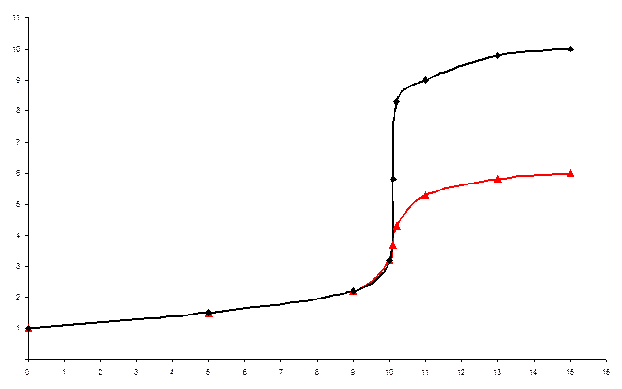
20-сурет. Кальций иондарын трилон Б-мен комплексонометрлік титрлеу қисықтары 1 – жанама реакцияны ескермегендегі титрлеу қисығы; 2 – рН = 10 болғанда жанама реакциясы ескерілген титрлеу қисығы
рН=6,0 болғанда кальций иондарын ЭДТА-мен комплексонометрлік титрлеу қисығын есептейміз. 1. 10 мл 0,1 М CaCl2 pCa1 = 1 2. 10 мл 0,1 М CaCl2 + 5 мл 0,1 М ЭДТА рСа2 = 1,5 3. 10 мл 0,1 М CaCl2 + 9 мл 0,1 М ЭДТА рСа3 = 2,3 4. 10 мл 0,1 М CaCl2 + 9,9 мл 0,1 М ЭДТА рСа4 = 3,3 5. 10 мл 0,1 М CaCl2 + 10 мл 0,1 М ЭДТА ер-ді: [CaY]2- Ca2+ + Y4- Û [CaY]2-; Y4- + 2H+ Û [H2Y]2-; bш = bК. aY4-
b у = 5.1010. 5.10-5 = 25.105 = 2,5.106 Ары қарай 6. 10 мл 0,1 М CaCl2 + 10,1 мл 0,1 М ЭДТА ер-ді: [CaY]2-, [Y4-] изб. [
7. 10 мл 0,1 М CaCl2 + 11 мл 0,1 М ЭДТА рСа7 = 5,4 8. 10 мл 0,1 М CaCl2 + 13 мл 0,1 М ЭДТА рСа8 = 5,8 9. 10 мл 0,1 М CaCl2 + 15 мл 0,1 М ЭДТА рСа9 = 6,0
21-сурет. Ерітіндінің әртүрлі қышқылдығында титрант көлемінен рСа тәуелділігі қисықтары Неғұрлым ерітінді қышқыл болса, соғұрлым протонизациялану жанама реакциясының әсері күшті, титрлеу қисығында секіру төмен.
|

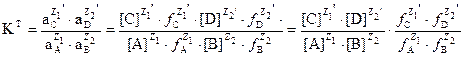 ;
; 
 ;
;  ;
;  ;
;  ;
; 
 .
. , (9)
, (9) (10);
(10); , (11)
, (11)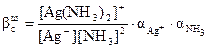 (12)
(12) (13)
(13)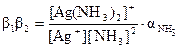 (14)
(14)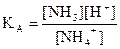 (15);
(15);  , (16)
, (16) (17);
(17);  (18).
(18).

 = b1 . b2 = b1K. b2K. a
= b1 . b2 = b1K. b2K. a  = 1,6.103. 6,7.103. (10-6)2 = 1,1.10-5
= 1,6.103. 6,7.103. (10-6)2 = 1,1.10-5 bш = 1,1.107. (0,5)2 = 2,7.106
bш = 1,1.107. (0,5)2 = 2,7.106 жанама реакция H+ + CN- Û HCN
жанама реакция H+ + CN- Û HCN 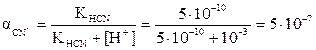
 = 1021. (5.10-7)2 = 2,5.108
= 1021. (5.10-7)2 = 2,5.108 рН = 7 мәнінде
рН = 7 мәнінде 
 » 3.10-2 рСа2 = 1,5
» 3.10-2 рСа2 = 1,5
 = 5.10-2
= 5.10-2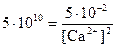
 рСа6 = 6,0
рСа6 = 6,0 = 5.10-4
= 5.10-4 pCa7 = 8,7
pCa7 = 8,7 (1)
(1)

 , себебі [Ca2+] = [Y4-];
, себебі [Ca2+] = [Y4-]; pCa6» 5,9
pCa6» 5,9
 = 4,9.10-4
= 4,9.10-4
 ;
;  ; рСа7 = 8,4
; рСа7 = 8,4

 ;
;  ; рСа5 = 3,9
; рСа5 = 3,9 ;
;  ;
; , рСа6 = 4,4.
, рСа6 = 4,4.